|
As síndromes coronarianas agudas (SCA), que incluem a angina instável, o infarto agudo do miocárdio com
ou sem onda Q e a morte súbita, dependem essencialmente de fenômenos que ocorrem na placa aterosclerótica. O resultado final de tais fenômenos é a oclusão total ou parcial da artéria coronária, causando graus distintos de lesão miocárdica, que variam desde isquemia moderada e transitória até necrose miocárdica irreversível. |
Autores Protásio Lemos da Luz(1) Roberto Esporcatte(2) (1)Diretor da Unidade Clínica de Aterosclerose do InCor - HC/FMUSP. (2)Professor Assistente de Cardiologia da Faculdade de Ciências Médicas da Universidade do Estado do Rio de Janeiro (UERJ); Coordenador Médico da Unidade Coronariana do Hospital Pró-Cardíaco. |
Alguns elementos são importantes no desencadeamento das SCAs, e podem ser referidos como responsáveis ou contribuintes da instabilização da placa. A lesão desencadeante destes eventos agudos pode ocorrer por erosão da superfície endotelial, por hemorragia intraplaca ou, mais freqüentemente, por ruptura da placa e conseqüente exposição do núcleo lipídico, levando a fenômenos trombóticos.
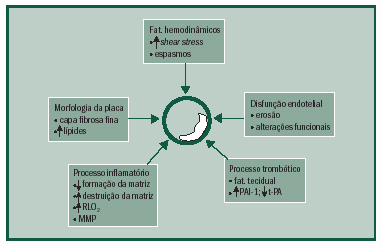
Na Figura, esquematizamos os vários fatores relacionados à instabilização da placa. Assim, fatores hemodinâmicos contribuem para sua ruptura. O estresse de cisalhamento (shear stress), causado por forças paralelas à superfície endotelial, pode levar à fadiga ou ruptura da capa fibrosa; porém a mais importante destas forças é o estresse circunferencial, que, seguindo a lei de Laplace, causa diferentes respostas nas várias regiões da placa. Quanto mais espessa é a capa fibrosa, menor é o estresse circunferencial da parede, e quanto maior o volume do núcleo lipídico, maior também é este estresse, principalmente próximo às bordas da íntima normal. Outro fator é o espasmo coronariano, que, apesar de muitas vezes estar associado à ruptura da placa, parece ser mais uma conseqüência do que causa desta.
A morfologia da placa também é importante. Ambrose et al. e Little et al. observaram que a magnitude das estenoses visualizadas em cinecoronariografia não é o único fator determinante da gravidade e evolução para SCAs; assim, em pacientes com IAM, demonstrou- se que 66% deles tinham estenose menor que 50%, e em 97% a estenose não chegava a 70%.
Já Gertz et al. e Roberts et al. encontraram grandes núcleos lipídicos (32% do total) em placas rotas associadas a infartos, enquanto nos segmentos com capas fibrosas intactas este volume perfazia 5% a 12% do total da placa. Também Davies et al., estudando segmentos de aortas, demonstraram que quanto mais o volume do núcleo lipídico contribui para o tamanho da placa, mais vulnerável é esta. Davies propôs que, se este núcleo lipídico ocupar mais de 40% do total da área da placa, existe um elevado risco de ruptura e trombose. Estima-se que o achado de lesões leves a
 moderadas associadas a eventos agudos ocorra
por maior presença deste tipo de placa e ausência de
circulação colateral; isto não quer dizer que grandes
estenoses não causem síndromes agudas; naturalmente
também o fazem. As placas ateroscleróticas consideradas
vulneráveis são caracterizadas por grande núcleo
lipídico, elevada densidade de macrófagos, elevada
expressão de fator tecidual, reduzido número de células
musculares lisas e uma fina capa fibrosa. Recentemente,
Higuchi et al. demonstraram que placas instáveis
têm remodelamento positivo, provavelmente por
uma inflamação mais intensa na adventícia, e as placas
estáveis se mantêm com mesmo diâmetro ou fazem
remodelamento negativo, por maior concentração
de fibrose na adventícia.
moderadas associadas a eventos agudos ocorra
por maior presença deste tipo de placa e ausência de
circulação colateral; isto não quer dizer que grandes
estenoses não causem síndromes agudas; naturalmente
também o fazem. As placas ateroscleróticas consideradas
vulneráveis são caracterizadas por grande núcleo
lipídico, elevada densidade de macrófagos, elevada
expressão de fator tecidual, reduzido número de células
musculares lisas e uma fina capa fibrosa. Recentemente,
Higuchi et al. demonstraram que placas instáveis
têm remodelamento positivo, provavelmente por
uma inflamação mais intensa na adventícia, e as placas
estáveis se mantêm com mesmo diâmetro ou fazem
remodelamento negativo, por maior concentração
de fibrose na adventícia.A disfunção endotelial também é fundamental. Vinte a 25% dos casos relacionados à trombose responsável por morte cardíaca ocorrem por uma erosão e perda superficial da integridade da íntima, porém sem ruptura. Lesões erosivas ocorrem mais em jovens e mulheres, têm menos calcificação, são mais freqüentes em artérias de menor calibre, porém em regiões de maior grau de estenose, além de possuírem menor concentração de macrófagos e células T em comparação às placas com ruptura. A erosão provoca exposição da superfície subendotelial, principalmente do colágeno e do fator tecidual, aos componentes do sangue, estimulando a formação de trombo mural. Discretas áreas de erosão levam a formações de pequenos trombos plaquetários sem importância clínica, que podem estimular a proliferação de células musculares lisas e a regeneração endotelial, ou alterar a resposta vasomotora da artéria, predispondo à vasoconstrição. Grandes áreas de erosão de células endoteliais levam à formação de trombos maiores com fibrina, células vermelhas e plaquetas, podendo ocorrer a oclusão parcial ou total do vaso e conseqüente sintomatologia.
Uma forma menos comum de ruptura da placa ocorre dentro desta, em direção à luz da artéria, dependente de uma elevada pressão intraplaca, que poderia ser causada por hemorragia a partir de vasa vasorum na placa.
Processo inflamatório talvez seja o determinante fundamental da ruptura. O principal responsável pela integridade da capa fibrosa é o colágeno intersticial dos tipos I e III, sintetizados predominantemente pelas células musculares lisas. Existem três fatores que podem levar à redução do colágeno: a) redução de síntese por células musculares lisas, que ocorre por ação da citocina interferon-gama, produzida por linfócitos T ativados em presença de inflamação crônica; b) redução do número de células musculares lisas, que também ocorre devido à ação de citocinas como o interferon-gama, a interleucina-1 e o fator de necrose tumoral-alfa, através tanto de inibição da proliferação, como por ativação de apoptose destas células musculares lisas; c) outra forma de agressão à capa fibrosa ocorre através de um conjunto de enzimas proteolíticas, metaloproteinases, principalmente a colagenase intersticial, gelatinase B e estromelisina, que geralmente estão presentes em quantidades mínimas, mas têm sua síntese muito aumentada pelos macrófagos. Esta família de enzimas, juntamente com os macrófagos ativados, tem a capacidade de digerir todos os componentes da matriz estrutural da capa fibrosa. Portanto a diminuição da síntese da matriz intersticial e o aumento de sua degradação contribuem para o enfraquecimento da capa fibrosa da placa.
Existem algumas evidências de que agentes infecciosos, principalmente a Chlamydia pneumoniae, possam participar deste processo inflamatório. Recentemente, Higuchi et al. demonstraram que esta bactéria se encontra em quantidade muito mais elevada na adventícia de placas instáveis do que em outros segmentos com placas estáveis.
Encontrou-se também expressão aumentada da enzima conversora de angiotensina (ECA) nas bordas de placas rotas, sugerindo que esta enzima poderia induzir variações na concentração local de angiotensina II e/ou bradicinina, podendo promover a instabilização destas placas. A hipertensão, também com sua ação pró-inflamatória, aumentaria a formação de peróxido de hidrogênio e radicais livres no plasma, que reduz a formação de óxido nítrico pelo endotélio, aumenta a adesão de leucócitos e aumenta a resistência periférica.
Por fim, o processo trombótico determina oclusão parcial ou total do vaso. Quando ocorre erosão endotelial, o colágeno exposto, associado ao fator de von Willebrand, ativa as plaquetas, promovendo sua adesão e agregação. Quando ocorre ruptura da capa fibrosa, a exposição do núcleo lipídico, principalmente por efeito do fator tecidual que tem um potente efeito pró-coagulante, ativa o fator VII, o qual ativará o fator X e a trombina, levando à formação do trombo. Pacientes com doença coronariana progressiva apresentam um estado de hipercoagulabilidade com aumento de fibrinogênio, fator VII, fator de von Willebrand e fibrinólise reduzida. A presença de nível elevado de inibidor de ativação do plasminogênio tecidual (PAI-1) tem sido demonstrada em estudos como fator de risco para doença isquêmica do miocárdio e infarto agudo, devido a um desequilíbrio entre fatores trombóticos e fibrinolíticos.
Como se vê, o processo de instabilização da placa envolve vários fatores, incluindo características estruturais da lesão, processos inflamatório e trombótico que finalmente causam redução do fluxo coronariano e as manifestações clínicas da isquemia.
Métodos diagnósticos atuais
Para o diagnóstico de IAM em evolução ou recente
deve ser documentada a liberação típica de marcadores
de necrose miocárdica (MNM): concentração
máxima de troponina T ou I excedendo o
percentil 99 em pelo menos uma dosagem ou valor
máximo de CK-MB (preferencialmente CK-MB determinada
pelo método de massa) excedendo o
percentil 99 em duas amostras sucessivas, ou, então,
valor máximo excedendo duas vezes o limite superior
do normal em dosagem realizada nas primeiras horas
após o evento índice. Assim, SCA com presença sérica
de MNM deve receber diagnóstico de (pequeno)
infarto do miocárdio.
Na angina instável, a intensidade e a duração do
processo agudo de isquemia não são suficientes para
produzir necrose miocárdica. Estes pacientes geralmente
não apresentam elevação de ST no eletrocardiograma
(ECG) e não há elevação dos MNM. Entretanto
a isquemia profunda pode permitir a
liberação de MNM de menor peso molecular, como
as troponinas, o que tem elevado valor prognóstico,
correlacionando-se com maiores taxas de óbito,
infarto e necessidade de revascularização, tanto na
fase hospitalar como na fase crônica.
No IAM sem supra de ST, a isquemia miocárdica
tem intensidade e duração suficientes para produzir
necrose miocárdica. O ECG inicial freqüentemente não
exibe elevação do ST, e a maioria dos pacientes não desenvolve
onda Q, justificando o diagnóstico final de
IAM sem onda Q. O IAM sem supra de ST é diferenciado
da AI pela detecção dos MNM que se elevam no
IAM sem supra de ST, mas não se elevam na AI. A
apresentação inicial pode ser SCA com ou sem supra
de ST. Geralmente o diagnóstico é feito retrospectivamente,
baseado na elevação dos MNM.
Na prática, o ECG admissional e seriado é essencial,
pois a identificação de supradesnivelamento
do segmento ST impõe a implementação de estratégias
de reperfusão como trombólise ou angioplastia,
enquanto na sua ausência ênfase maior terá
o uso de antiagregantes plaquetários, antitrombínicos
e a estratificação para eventual estudo coronariográfico.
Novos marcadores de necrose
miocárdica e inflamação
sistêmica
Sinais, sintomas e eletrocardiograma freqüentemente são atípicos ou inconclusivos. A presença do supradesnivelamento de ST em pacientes com quadro clínico de dor precordial tem alto valor preditivo para a presença de IAM (> 95%), e a dosagem de MNM séricos pouco se altera na avaliação diagnóstica. É no grupo de pacientes sem supradesnivelamento de ST que a confirmação laboratorial de necrose miocárdica é mais importante, permitindo distinguir o infarto sem onda Q da angina instável e estratificar os pacientes. Idealmente, o MNM deveria ser 100% miocárdico- específico, com liberação celular e depuração plasmática rápidas, com relação linear com grau de injúria e aferida por método de execução fácil, imediata e barata. Nenhum MNM preenche isoladamente todos estes quesitos, portanto utilizamos associação de métodos para maior precisão diagnóstica. A Tabela apresenta a cinética dos principais MNM incorporados à prática atual.
Troponinas
O complexo protéico das troponinas compreende as unidades C, T (TnT) e I (TnI). A TnI é mais específica para o miocárdio, não se eleva em doenças musculares esqueléticas nem em pacientes com insuficiência renal. As troponinas são os marcadores de dano miocárdico mais recentemente descritos e recomendados em face da sua especificidade quase absoluta, assim como elevada sensibilidade, refletindo, desta forma, zonas até mesmo microscópicas de necrose miocárdica. Frente à sua maior especificidade para a detecção de pequenos danos miocárdicos, estima-se que cerca de 30% dos pacientes que se apresentam sem supradesnivelamento do segmento ST, e que seriam classificados como portadores de angina instável, na verdade estariam evoluindo com IAM sem onda Q.

A TnI aumenta 3-12h após o IAM, com pico
em torno de 24 horas, normalizando em cinco a dez
dias. Possui sensibilidade de quase 100% entre 12h
e 72h e especificidade de 97,4%, não sendo detectado
em pessoas saudáveis. É um excelente marcador
diagnóstico em caráter retrospectivo, assim como
em pós-operatório de cirurgia cardíaca. Níveis elevados
de troponinas por si só discriminam pacientes
com alto risco para eventos adversos tais como
óbito, infarto ou outras intercorrências isquêmicas.
Pacientes com MNM positivo são aqueles que mais
se beneficiam de novas estratégias terapêuticas, como
o uso de heparinas de baixo peso molecular, inibidores
da glicoproteína IIb/IIIa e intervenção
coronariana precoce.
Creatinofosfoquinase (CPK) e frações
A CPK eleva-se entre 4h e 8h após o IAM, com
pico médio aproximadamente em 24 horas, normalizando
em dois a três dias. Para ser considerada diagnóstica
de IAM, a CPK deve elevar-se pelo menos duas
vezes acima do limite superior da referência. Resultados
falsos positivos ocorrem em cerca de 15%, especialmente
na presença de doenças musculoesqueléticas, diabetes
melito, intoxicação alcoólica, exercícios vigorosos,
convulsões, acidentes vasculares encefálicos, insuficiência
renal, traumas musculares e tromboembolismo pulmonar.
Recentes técnicas analíticas permitiram a
quantificação da massa da CK. Na dosagem das
isoenzimas da CPK (frações MM, MB e BB), onde a
fração MB é a mais específica para o IAM, é importante
ressaltar que podem ocorrer elevações em outras
doenças, como do intestino delgado, da tireóide, da
língua, do diafragma, do útero e da próstata. Se a
mensuração das troponinas não for disponível, a melhor
alternativa é a detecção da CK-MB pelo método
de massa.
Mioglobina
A mioglobina é mais sensível e específica do que a CK-MB, aumentando entre 1h e 4h após o IAM, com pico entre 6h e 7h, normalizando-se em cerca de 24h. Possui um valor preditivo negativo de quase 100%, é facilmente mensurável, demorando cerca de 10min a 15min para se realizar o exame. Também apresenta elevação na angina instável, cirurgias ou traumas recentes, pós-convulsões, exercícios intensos, doenças musculares, após manobras de ressuscitação cardiopulmonar, injeções intramusculares e insuficiência renal. A utilização clínica da mioglobina, assim como das isoformas da CK-MB, pode ser considerada frente à necessidade de diagnóstico precoce, mas um marcador de elevação mais tardia deve ser empregado para confirmação diagnóstica.
Aspartato aminotransferase
Eleva-se entre 8h e 12h após o IAM, com o pico de elevação entre 18h e 36h, normalizando-se em três a quatro dias. Apresenta baixíssima especificidade, sendo de pouca utilidade prática e devendo ser substituída pelos outros marcadores.
Desidrogenase láctica
A LDH eleva-se após 10 horas do IAM, com pico
máximo entre 24h e 48h e normalização em oito a 14
dias. Possui cinco isoenzimas da LDH, sendo a LDH1
a mais específica para o miocárdio, elevando-se oito a
24 horas após o IAM. Em mais de 95% dos pacientes
é observado um aumento na relação LDH1/LDH2,
usando-se a referência = 1 para o diagnóstico de IAM.
Atualmente, a análise das isoenzimas da LDH não se
justifica em face da ampla disponibilidade das
isoenzimas da CK. Devido às baixas especificidade e
sensibilidade quando comparada com as troponinas
recomenda-se que a LDH também seja substituída
pelos novos MNM.
Proteína C reativa (PCR)
As respostas de fase aguda são induzidas por
citocinas liberadas de tecidos inflamados, podendo
elevar a síntese hepática de alguns elementos como
a PCR, fibrinogênio, amilóide sérico A e ferritina,
ou reduzir os níveis de outras proteínas, como a
albumina e a transferrina. O papel fisiológico da
PCR nos mecanismos da homeostase não está bem
compreendido, mas a sua relação com a doença cardiovascular
é amplamente reconhecida. Elevações da
PCR podem refletir ação de agentes infecciosos,
extensão e gravidade da aterosclerose, isquemia ou
necrose miocárdica, ou mesmo expressão de elevadas
quantidade e atividade de citocinas pró-inflamatórias
circulantes.
Níveis elevados de PCR na admissão, durante a
internação ou mesmo na pré-alta hospitalar guardam
elevado poder preditivo de eventos adversos a
médio e longo prazos. Porém parece incerto que
níveis elevados devam merecer terapia inflamatória
específica. Assim, a dosagem de rotina de PCR não
parece ser justificada.
Contribuições adicionais e
particularidades da
eletrocardiografia
convencional
Os achados eletrocardiográficos dependem de vários
fatores relacionados à isquemia miocárdica, em
especial sua duração (hiperaguda, aguda e crônica), extensão
(transmural ou subendocárdica) e localização
(anterior, inferior, posterior, ou combinações). Claramente,
anormalidades persistentes e transitórias do segmento
ST e modificações de onda Q ou T em traçados
seriados apresentam maior poder discriminatório
de isquemia aguda ou infarto do que aquelas observadas
em um único ECG.
Tradicionalmente são descritas quatro apresentações
de SCA, onde a isquemia miocárdica determina diferentes
manifestações eletrocardiográficas: (1) isquemia
subendocárdica, com depressões transitórias do segmento
ST; (2) isquemia transmural sem infarto, observada
na angina variante de Prinzmetal, caracterizada por elevações
transitórias do segmento ST ou normalização da
onda T paradoxal; (3) infarto sem onda Q, caracterizado
pela depressão ST ou inversão de onda T, sem aparecimento
de onda Q e com elevação MNM; e (4) infarto
com ondas Q, as quais geralmente são precedidas por
onda T hiperaguda e elevação de ST. As recomendações
atuais dividem as SCA em apresentações com ou sem
supradesnivelamento de segmento ST, conferindo à
apresentação clínica e ao ECG maior poder de decisão
e orientação terapêutica mais prática e eficaz. Assim, a
presença de sintomas típicos de SCA com mais de 30
min de duração, associados ao supradesnível de ST sem
alívio com o uso de nitratos, recomenda o emprego
imediato das estratégias de reperfusão. Se não houver
elevação de ST, o quadro é compatível com angina instável,
sendo que a presença de infra de ST confere maior
risco de eventos e recomenda a utilização de terapia
antitrombótica plena, com antiagregantes plaquetários
orais (ácido acetilsalicílico e clopidogrel) e venosos (inibidores
da glicoproteína IIb/IIIa), antitrombínicos
(heparina não-fracionada venosa ou de baixo peso
molecular por via subcutânea), assim como definição
da anatomia coronariana com estudo hemodinâmico
nas primeiras 48 horas.
Localização da isquemia ou
infarto e correlação
coronariográfica
O ECG pode sugerir diagnósticos mais precisos e
informações detalhadas sobre o possível acometimento
da anatomia coronariana a partir da identificação
de alguns achados:
- No infarto da parede anterior, supra de ST em aVR,
bloqueio completo de ramo direito, depressão de ST
em V5 e elevação de ST em V1 maior que 2,5mm
são fortes preditores de oclusão de artéria coronária
descendente anterior (ACDA), proximal à primeira
perfurante septal; ondas Q em V4 e V5 são associadas
com oclusão de ACDA distal à primeira septal.
Além disso, ondas Q patológicas em aVL estão associadas a oclusão de ACDA proximal ao primeiro ramo diagonal (ADg1), enquanto depressão de ST em aVL sugere oclusão distal a ADg1. A presença de depressão de ST 1mm em parede inferior, associada ao supra de ST em aVL, sugere oclusão de ACDA proximal tanto a septal como a ADg1, enquanto a ausência de infradesnível de ST está associada a oclusão distal.
- Infarto posterior deverá ser suspeitado pela observação
de infradesnível de ST na parede ântero-septal
(V1 a V3), com posterior aumento da amplitude da
onda R. Derivações posteriores (V7, V8 e, eventualmente,
V9) confirmarão o diagnóstico e são obrigatórias
frente à suspeita de SCA, especialmente na fase
inicial. A parede posterior pode ser acometida por
lesões em artéria coronária direita (ACD) ou circunflexa
(ACx), sendo que a depressão de ST ânteroseptal
é um indicador sensível, mas não específico,
de acometimento da ACx. A ausência de depressão
de ST precordial tem alto valor preditivo negativo
em excluir a ACx como a artéria culpada. A relação
entre a depressão de ST em V3 e a elevação de ST em
DIII também pode ser útil para identificar artéria
culpada em pacientes com infarto inferior: se > 1,2,
sugere ACx (sensibilidade = 84% e especificidade =
95%); e, se < 0,5, sugere ACD (sensibilidade = 91%
e especificidade = 91%).
- No infarto inferior, a presença de elevação de ST em
DIII maior que DII, especialmente quando combinada
com supra de ST em V1, e a presença de depressão
de ST em DI são potentes preditores de oclusão da
ACD em suas porções proximal ou média. A presença
de elevação de ST em DII igual à DIII é importante
preditor de oclusão de ACx.
- Elevações de ST nas derivações torácicas direitas, particularmente em V4R, são indicativas de acometimento associado de ventrículo direito e correlacionamse com oclusão proximal de ACD, com sensibilidade de 88% e especificidade de 78% em pacientes com infarto inferior.
Métodos de imagem no
diagnóstico das SCA
Ecocardiografia
As indicações preconizadas para o ecocardiograma
transtorácico convencional na sala de emergência são
potencialmente amplas, devendo ser salientadas as contribuições
específicas do método em: 1) presença de dor
sugestiva de isquemia miocárdica aguda, com o ECG
basal não-diagnóstico (maior valor preditivo); 2) no diagnóstico
diferencial de SCA com dissecção aórtica,
embolia pulmonar, doença orovalvar, pericárdica ou
cardiomiopatias; 3) em vigência de instabilidade hemodinâmica.
O método de ecocardiografia com contraste,
que permite avaliação simultânea de contração e perfusão
miocárdica, é potencialmente de grande utilidade, mas
necessita ainda de validação clínica.
A detecção de alterações segmentares transitórias
durante ou logo após episódios de dor permite a correlação
com a artéria envolvida e com a quantidade de
miocárdio em risco. O método permite excelente avaliação
da função ventricular esquerda e deve ser realizado
eletivamente nos paciente admitidos por SCA.
Os objetivos principais dos testes provocativos são
determinar a presença ou ausência de isquemia em pacientes
com baixa probabilidade de coronariopatia e
estimar o prognóstico. A ecocardiografia ou outros testes
não-invasivos com estresse físico ou farmacológico
podem ser considerados na dependência das características
do paciente, da disponibilidade local e principalmente
da capacitação técnica do examinador.
Cardiologia nuclear
Embora a cintigrafia com tálio seja um método
confiável para detecção de infarto agudo, sua rápida
redistribuição é importante limitação para documentar
episódios transitórios de dor torácica, como ocorre na
angina instável. Com a estabilização do paciente e o
alívio dos sintomas após administração do tálio, alterações
do padrão de atividade (redistribuição) podem ocorrer
e contribuir para achados falsos negativos. Por outro
lado, marcadores empregando tecnécio99m, tais como
sestamibi e tetrofosmin, são adequados para avaliação
de pacientes com dor torácica, pois apresentam estabilidade
na distribuição de atividade e as imagens podem
ser obtidas várias horas após injeção, permitindo medidas
terapêuticas prévias à confirmação diagnóstica, tais
como antiagregantes plaquetários e nitratos.
Bilodeau et al. analisaram imagens com Tc99m
sestamibi em pacientes com suspeita de angina instável,
encontrando sensibilidade de 96% e especificidade de
79%, bastante superiores às observadas com dados eletrocardiográficos
(35% e 74%, respectivamente). Mesmo
em pacientes livres de sintomas no momento da
injeção, a cintigrafia demonstrou melhor sensibilidade
que o eletrocardiograma, além de permitir localização
da região de hipoperfusão, a qual se correlacionou com
a lesão arterial mais grave em 88% dos casos.
A sensibilidade da cintigrafia miocárdica na detecção
do IAM foi de 100% no estudo de Tatum et al. e, nos
pacientes com exames negativos, o acompanhamento
por um ano revelou taxa de revascularização de 3% e
nenhum caso de IAM ou óbito. Não era necessária a
presença de sintomas para injeção, e a sensibilidade não
era significativamente diferente se a injeção fosse realizada
em vigência ou não de sintomas álgicos.
De maneira consistente, todos estudos de pacientes
observados em emergência por dor torácica e com
cintigrafia de perfusão miocárdica normal demonstram
baixa probabilidade de doença arterial coronariana, enquanto
que imagens anormais identificam pacientes
com maior probabilidade a coronariopatia e eventos
subseqüentes.
Limitações
Diversos estudos relatam importante perda da acurácia diagnóstica do método quando se comparam injeções realizadas durante a dor ou após sua resolução. Todos os estudos de perfusão aguda foram realizados em pacientes sem infarto prévio. Não há método atual que possa determinar se o déficit de perfusão é antigo, refletindo infarto prévio, ou recente, sugerindo processo isquêmico agudo. A associação com outros índices é então necessária. Limitação importante naturalmente é a disponibilidade de recursos institucionais adequados. Segundo as diretrizes da SBC, a cintigrafia miocárdica de perfusão em pacientes com angina instável pode ser realizada em pacientes considerados de baixo risco, tanto precocemente (48h/72h), após a alta hospitalar, como com o protocolo de repouso (durante a dor) no setor de emergência e estresse no dia seguinte. Ainda segundo estas recomendações, a utilização da cardiologia nuclear de rotina na população de dor torácica aguda não é justificada pelos aspectos clínicos e de custo/benefício, mas representa valiosa alternativa na presença de ECG normal ou não-diagnóstico.
Teste ergométrico no
diagnóstico das SCA
Pela sua simplicidade, baixo custo e domínio
amplo de técnica e interpretação, o teste ergométrico
(TE) é exame muito útil para os pacientes que podem
se exercitar e que apresentam segmento ST passível
de interpretação. Importante experiência nacional
demonstrou que o TE possui excelente acurácia
diagnóstica para afastar o diagnóstico de angina instável
em uma população em avaliação emergencial
de dor torácica (sensibilidade = 73%, especificidade=
92%, valor preditivo positivo = 61%, valor preditivo
negativo = 95%)(28, 29). Em mil pacientes com suspeita
de isquemia miocárdica aguda considerada de
baixo risco, Amsterdam et al. não observaram efeitos
adversos com a realização de TE limitado por
sinais ou sintomas. O exame foi positivo em 13%,
negativo em 64%, e não-diagnóstico em 23% dos
pacientes. Ao final de 30 dias, houve poucos eventos
adversos, sendo um IAM sem Q no grupo TE
negativo, quatro IAM sem Q e 12 revascularizações
no positivo, sete revascularizações no inconclusivo
e nenhum óbito, caracterizando plena segurança e
acurácia do método.
Nos pacientes admitidos por angina instável de
risco baixo ou intermediário, TE pode ser aplicado
aos pacientes clinicamente estáveis há pelo menos 48
horas. Usuários de digital, assim como os portadores
de hipertrofia ventricular esquerda, bloqueio de ramo
esquerdo, marca-passo ou síndrome de pré-excitação,
devem ser submetidos a outros métodos de estresse.
Na presença de limitação física, a ecocardiografia ou
a cintigrafia com estresse farmacológico (dobutamina,
dipiridamol) devem ser consideradas.
Índices não-invasivos de risco em
SCA sem supra de ST
O risco para eventos adversos tem sido avaliado com
a análise multivariada de parâmetros obtidos em grandes
ensaios clínicos, e diversos escores têm sido propostos. Os
parâmetros mais importantes associados com óbito são
idade, freqüência cardíaca, pressão arterial sistólica, depressão
de ST, sinais de insuficiência cardíaca e elevação de
marcadores de necrose miocárdica.
O grupo Timi desenvolveu escore com sete pontos
que tem se mostrado bastante útil na prática diária e com
grande aceitação pela comunidade científica. Atribuindose
um ponto para cada critério (idade maior que 65 anos,
três ou mais fatores de risco coronariano, angiografia prévia
com obstrução coronariana > 50%, uso de AAS nos
sete dias precedentes, dois ou mais episódios anginosos
nas últimas 24 horas, desnível de ST e presença de marcadores
de necrose miocárdica), o risco de óbito, infarto ou
necessidade de revascularização urgente variou entre 5% e
41%, de acordo com a soma de pontos.
Coronariografia
A coronariografia está indicada aos pacientes com SCA
de moderado/alto risco; especificamente aqueles sem supra
de ST que apresentam recorrência de sintomas apesar
de adequadamente medicados, evoluem com
intercorrências de alto risco como insuficiência cardíaca,
ou arritmias malignas, ou apresentam índices prognósticos
derivados dos exames não-invasivos desfavoráveis
(disfunção ventricular importante, fração de ejeção < 0,35,
amplos ou múltiplos defeitos de perfusão). Pacientes com
intervenção coronariana cirúrgica ou angioplastia prévia
também devem ser submetidos a estudo hemodinâmico.
Entre os recentes avanços, a ultra-sonografia intravascular
(USIV) associada à angiografia destaca-se como nova ferramenta
diagnóstica e terapêutica, sendo capaz de detectar
lesões ocultas em regiões angiograficamente normais,
quantificar lesões duvidosas e identificar placas predispostas
à ruptura.
Nota do editor
Os doutores Protásio e Esporcatte tratam com propriedade e precisão de um assunto de extrema importância para a prática
cardiológica. Eles retratam bastante bem o papel da clínica no diagnóstico das síndromes coronarianas agudas, dispensando
métodos sofisticados de diagnóstico. Por certo a falta de espaço impediu-lhes de descer a alguns detalhes deveras importantes, e
os questionamentos a seguir serão respondidos pelos autores em contribuições futuras próximas.
Por que os marcadores de necrose e infarto agudo do miocárdio devem ser baseados em duas tomadas sucessivas? Não se trata
aqui de um conceito baseado em evidências. No que toca ao teste de esforço, por exemplo, fala-se em teste útil, no entanto a
sua sensibilidade e a sua especificidade são muito baixas. É outra maneira de se transformar, como é comum hoje na
literatura, resultados negativos em resultados positivos. Convenhamos que chamar uma sensibilidade de 73% de excelente é
uma crença subjetiva. Assim, por exemplo, os dados de Amsterdam não corroboram estes estudos.
Outro aspecto que necessita de um tratamento mais adequado é o ecocardiograma com dobutamina nas síndromes
coronarianas agudas. Na realidade trata-se de um teste extremamente penoso para o paciente, se executado da maneira
devida, e é minha opinião que a interpretação do ecocardiograma neste particular é um exercício de fantasia. Estes assuntos
serão discutidos pelos autores em número próximo.
Referências Bibliográficas
1. ADAMS III, J. E. et al. Cardiac troponin I: a marker with high
specificity for cardiac injury. Circulation, v. 88, p. 101, 1993.
2. ALPERT, J. S. et al. Myocardial infarction redefined: a consensus
document of the Joint European Society of Cardiology/American
College of Cardiology Committee for the redefinition of myocardial
infarction. J Am Coll Cardiol, v. 3, p. 959, 2000.
3. AMBROSE, J. A. et al. Angiographic progression of coronary artery
disease and the development of myocardial infarction. J Am Coll Cardiol,
v. 12, p. 56-62, 1988.
4. AMSTERDAM, E. A. et al. Immediate exercise testing to evaluate
low-risk patients presenting to the emergency department with chest
pain. J Am Coll Cardiol, v. 40, p. 251, 2002.
5. ANTMAN, E. M. et al. The Timi risk score for unstable angina/non-
ST elevation MI: a method for prognostication and therapeutic decision
making. JAMA, v. 284, p. 835-42, 2000.
6. BASSAN, R. et al. Eficácia de uma estratégia diagnóstica para
pacientes com dor torácica e sem supradesnível do segmento ST na
sala de emergência. Arq Bras Cardiol, v. 74, p. 405, 2000.
7. BILODEAU, L. et al. Technetium-99m sestamibi tomography in
patients with spontaneous chest pain: correlations with clinical,
electrocardiographic and angiographic findings. J Am Coll Cardiol, v.
18, p. 1684, 1991.
8. BOERSMA, E. et al. Predictors of outcome in patients with acute
coronary syndromes without persistent ST-segment elevation. Results
from an international trial of 9461 patients. The PURSUIT investigators.
Circulation, v. 101, p. 2557, 2000.
9. BOGATY, P. et al. Vasoreactivity of the culprit lesion in unstable
angina. Circulation, v. 90, p. 5-11, 1994.
10. BRAUNWALD, E. et al. ACC/AHA guideline update for
the management of patients with unstable angina and on STsegment
elevation myocardial infarction: a report of the
American College of Cardiology/American Heart Association
Task Force on Practice Guidelines (Committee on the
Management of Patients With Unstable Angina). 2002. Disponível
em:
11. CANNON, C. P. et al. Comparison of early invasive and conservative
strategies in patients with unstable coronary syndromes treated with the
glycoprotein IIb/IIIa inhibitor tirofiban. N Engl J Med, v. 344, p. 1879,
2001.
12. DANESH, J. et al. Low grade inflammation and coronary heart
disease: prospective study and updated meta-analyses. BMJ, v. 321, p.
199, 2000.
13.DAVIES, M. J. A macro and micro view of coronary vascular insult
in ischaemic heart disease. Circulation, v. 82, suppl. II, p. 38-46, 1990.
14. DAVIES, M. J. Stability and instability: two faces of coronary
atherosclesosis. The Paul Dudley White Lecture 1995 - Circulation, v. 94,
p. 2013-20, 1996.
15. DIRETRIZES DA SOCIEDADE BRASILEIRA DE
CARDIOLOGIA SOBRE ANGINA INSTÁVEL E INFARTO
AGUDO DO MIOCÁRDIO SEM SUPRADESNÍVEL DO
SEGMENTO ST. Arq Bras Cardiol, v. 77, suplemento II, p. 1,
2001.
16. FARB, A. et al. Coronary plaque erosion without rupture into a
lipid core. Circulation, v. 93:1354-63, 1996.
17. GALIS, Z. S. et al. Increasead expression of matrix metalloproteinases
and matrix degrading activity in vunerable regions of human
atherosclerotic plaques. J Clin Invest, v. 94, p. 2493-503, 1994.
18. GENG, Y. J. et al. Apoptosis of vascular smooth muscle cells induced
by in vitro stimulation with interferon-gamma, tumor necrosis factoralpha
and interleukin-1 beta. Arterioscler Thromb Vasc Biol, v. 91, p. 2703-
11, 1996.
19. GERTZ, S. D.; ROBERTS, W. C. Hemodynamic shear force in
rupture of coronary arterial atherosclerotic plaques. Am J Cardiol, v. 66,
p. 1368-72, 1990.
20. GIBLER, W. B. et al. A rapid diagnostic and treatment center for
patients with chest pain in the emergency department. Ann Emerg Med,
v. 25, p. 1, 1995.
21. GIBLER, W. B. et al. Acute myocardial infarction in chest pain
patients with nondiagnostic ECGs: serial CK-MB sampling in the
emergency department: The Emergency Medicine Cardiac Research
Group. Ann Emerg Med, v. 21, p. 504, 1992.
22. GOLDMAN, L. et al. A computer protocol to predict myocardial
infarction in emergency department patients with chest pain. N Engl J
Med, v. 318, p. 797, 1988.
23. HIGUCHI, M. L. et al. Adventitial fibrosis and inflammation
surrounding atheroma: implications for different arterial remodeling in
stable and unstable plaques. J Am Coll Cardiol, v. 35, suppl. A, p. 368,
2000.
24. HIGUCHI, M. L. et al. Detection of Mycoplasma pneumoniae and
Clamydia pneumoniae in ruptured atherosclerotic plaques. Brazilian J
Med Biolog Res, v. 33, p. 1023-6, 2000.
25. JESSE, R. Myocardial necrosis in "pure unstable angina":
identification of high-risk subgroups or a contradiction in terms? Am
Heart J, v. 137, p. 190, 1999.
26. KIM, S. C.; ADAMS, S. L; HENDEL, R. C. Role of nuclear
cardiology in the evaluation of acute coronary syndromes. Ann Emerg
Med August, v. 30, p. 210-8, 1997.
27. LEE, T. H.; JUAREZ, G.; COOK, E. F. Ruling out myocardial
infarction. N Eng J Med, v. 324, p. 1239, 1991.
28. LIBBY, P. Molecular bases of the acute coronary syndromes
Circulation, v. 91, p. 2844-50, 1995.
29. LITTLE, W. C. et al. Can coronary angiography preditc the site
of a subsequent myocardial infarction in patients with mild to
moderate coronary artery disease? Circulation, v. 78, p. 1157-66,
1988.
30. LIUZZO, G. et al. The prognostic value of C-reactive protein and
serum amyloid A protein in severe unstable angina. N Engl J Med, v.
331, p. 417, 1994.
31. MACACIEL, R. et al. Avaliação de pacientes com dor torácica em
emergência hospitalar através do teste ergométrico. Rev Socerj, v. 11,
supl. A, p. 15, 1998.
32. MORROW, D. A. et al. Cardiac troponin I for stratification of early
outcomes and the efficacy of enoxaparin in unstable angina: a Timi 11B
substudy. J Am Coll Cardiol, v. 36, p. 1812, 2000.
33. NISSEN, S. E.; YOCK, P. Intravascular ultrasound: novel
pathophysiological insights and current clinical applications.
Circulation, v. 103, p. 604, 2001.
34. OHISHI, M. et al. Enhanced expression of angiotensin-converting
enzyme is associated with progression of coronary atherosclerosis in
humans . J Hypertens, v. 15, p. 1295-302, 1997.
35. OHMAN, E. M. et al. Cardiac troponin T levels for risk stratification
in acute myocardial ischemia. N Eng J Med, v. 335, p. 1333, 1996.
36. RICHARDSON, P. D.; DAVIES, M. J.; BORN, G. V. R. Influence
of plaque configuration and stress distribution on fissuring of coronary
atherosclerotic plaques. Lancet, p. 2941-4, 1989.
37. ROBERTS, R.; FROMM, R. E. Management of acute coronary
syndromes based on risk stratification by biochemical markers: an idea
whose time has come. Circulation, v. 98, p. 1831-3, 1998.
38. SCARABIN, P. Y. et al. Associations of fibrinogen, factor VII
and PAI-1 with baseline findings among 10.500 male participants
in a prospective study of myocardial infarction: the Prime study.
Thromb Haemost, v. 80, p. 749-56, 1998.
39. THE CAPTURE INVESTIGATORS. Randomized placebocontrolled
trial of abciximab before and during coronary intervention
in refractory unstable angina: the Capture Study. Lancet, v. 349, p.
1429, 1997.
40. THOMPSON, S. G. et al. Hemostatic factor and the risk of
myocardial infarction or sudden death in patients with angina
pectoris. N Engl J Med, v. 332, p. 635-41, 1989.
41. VANHOUTTE, P. M.; BOULANGER, C. M. Endotheliumdependent
responses in hypertension. Hypertens Res, v. 18, p. 87-98,
1995.