|
Agentes Trombolíticos De maneira global, todos os agentes trombolíticos disponíveis reduzem a mortalidade do infarto agudo do miocárdio (IAM) com supra de ST em cerca 30%, ou seja, taxas em torno de 7% a 10% nos grandes ensaios. Nas revisões de bancos de dados provenientes de comunidades, a mortalidade absoluta tem sido um pouco maior, em torno de 12% a 14%, refletindo melhor a prática clínica. Com base no estudo Gusto-1, o maior ensaio sobre trombolíticos no IAM já realizado, o ativador do plasminogênio tecidual parece produzir maior benefício global que a estreptoquinase, associando-se a uma redução absoluta da mortalidade de 1% (6,3% vs. 7,3%), o que equivale a uma redução relativa de 15%. Devido ao preço do ativador do plasminogênio tecidual recombinante (tPA) ser excessivamente maior, a estreptoquinase (SK) deve ser a droga trombolítica de eleição em nosso meio. |
Autores Fernando Oswaldo Dias Rangel - Doutorando de Cardiologia da Universidade Federal do Rio de Janeiro (UFRJ); Presidente do Departamento de Emergência e Terapia Intensiva da Sociedade de Cardiologia do Estado do Rio de Janeiro; Médico da Unidade Coronariana do Hospital Pró-Cardíaco; Médico do CTI de pós-operatório do Instituto Nacional de Cardiologia de Laranjeiras. Roberto Esporcatte - Professor Assistente de Cardiologia da Faculdade de Ciências Médicas da Universidade do Estado do Rio de Janeiro (FCM/Uerj); Coordenador Médico da Unidade Coronariana do Hospital Pró-Cardíaco. |
A clássica indicação para o tratamento trombolítico do IAM é a presença de quadro clínico compatível com isquemia miocárdica aguda refratária ao uso de nitrato sublingual, em associação a alterações eletrocardiográficas (ECG) com supradesnível de segmento ST > 0,1mV em duas ou mais derivações contíguas ou padrão de bloqueio de ramo recente. O Quadro resume as principais contra-indicações absolutas e relativas ao uso dos agentes trombolíticos referendadas pela Sociedade Brasileira de Cardiologia.
A SK é constituída por uma cadeia polipeptídica única cuja ligação ao plasminogênio forma um complexo ativo capaz de clivar pontes peptídicas de outras moléculas de plasminogênio, levando à ativação da plasmina. A dose recomendada é de 1.500.000 unidades administradas em infusão por 60 minutos. A recomendação de não-utilização rotineira de heparina como terapia coadjuvante da trombólise com SK é ainda bastante controversa. No estudo AMI-SK, com quase 500 pacientes, a enoxiparina como terapia coadjuvante foi superior ao placebo, determinando melhor resolução de ST, maior taxa de fluxo Timi-3 (58,7% vs. 70,3%, p = 0,01) ao final de cinco a dez dias e sugerindo menor incidência de óbito, infarto ou angina em 30 dias (13,4% vs. 21%).
Outros problemas da SK são relacionados à sua antigenicidade, propiciando imunossensibilização e reações alérgicas e recomendando que seja evitada sua readministração no período entre cinco dias e dois anos após uma primeira exposição. A hipotensão arterial ocorre especialmente com maior velocidade de infusão (> 500 unidades/kg/min) e pode ser controlada com reposição de cristalóides, interrupção ou redução da velocidade de infusão, ou mesmo com associação de aminas vasoativas como a dopamina. Sangramento é a complicação mais comum, com pequenas hemorragias nos sítios de punção em 3% a 4% dos pacientes.
Grandes sangramentos são menos comuns, e o risco de hemorragia intracraniana é < 1%, elevando-se a 1,6% nos pacientes acima de 70 anos.
O tPA apresenta grande fibrinoespecificidade e, quando ligado à fibrina, aumenta ainda mais sua afinidade pelo plasminogênio. Outra importante propriedade do tPA é a sua curta meia-vida (três a quatro minutos), o que impõe prolongada e complexa administração: 15mg em bolo + 0,75mg/kg (máximo = 50mg) em 30 minutos + 0,5mg/kg (máximo = 35mg) em 60 minutos. Diferentemente da SK, o tPA necessita da administração concomitante de heparina não-fracionada venosa (que deve ser mantida por pelo menos 24-48 horas) para manter a patência vascular e prevenir a reoclusão, o que representa uma dificuldade a mais. A heparinização deve ser implementada com ajuste de doses baseado no peso, com ataque de 60U/kg (máximo = 4.000U), seguida de infusão de 12U/kg/h (iniciar com máximo = 1.000U/h), objetivando tempo de tromboplastina parcial ativado entre 50 e 70 segundos. Embora ainda não incorporada nas recomendações das principais sociedades de cardiologia, a substituição da heparina não-fracionada pelas heparinas de baixo peso molecular surge como prática e promissora opção terapêutica. No estudo Hart-2, a taxa de patência vascular (Timi-2 ou 3) foi maior com enoxiparina do que com heparina não fracionada (80,1% vs. 75,1%), com menor incidência de reoclusão (5,9% vs. 9,8%). A principal complicação com o uso de tPA é o sangramento, e, em pacientes acima de 70 anos, a incidência de acidente vascular encefálico é maior do que com a SK (2,6% vs. 1,6%).

Peso < 70kg, pressão arterial > 170/95mmHg e
heparinização agressiva são outros fatores associados à
maior incidência de hemorragia cerebral.
Estes agentes trombolíticos já plenamente incorporados
ao arsenal terapêutico ainda apresentam importantes
limitações, como a falha em obter patência
coronariana em 15% a 20% dos pacientes, 10% a 15%
de reoclusão e o risco de hemorragia intracraniana.
Entre os novos agentes trombolíticos desenvolvidos para
suplantar estas limitações, as drogas obtidas por manipulações
da molécula nativa do tPA, também denominadas
ativadores de plasminogênio de terceira geração,
onde se destacam o r-PA (ou reteplase), o n-PA
(ou lanoteplase) e o TNK-tPA (ou tenecteplase), são
as mais amplamente avaliadas em ensaios clínicos.
Outros agentes em estudo são a estafiloquinase
recombinante e o ativador do plasminogênio obtido
de uma espécie de morcego hematófago (bat PA). Estes
agentes têm em comum prolongada meia-vida, o
que possibilita administração em bolo. Três deles
(TNK-tPA, estafiloquinase e bat PA) apresentam elevada
fibrinoespecificidade, com conseqüente mínima
degradação de fibrinogênio, e teoricamente todos seriam
mais potentes na lise do trombo intracoronariano.
Recente revisão de 38 ensaios envolvendo estes
novos agentes concluiu que o rPA e o TNK-tPA são
semelhantes ao tPA em termos de eficácia e segurança
(Figura). Embora no estudo InTime-II on-PA apresentasse
a mesma eficácia que o tPA em relação à mortalidade,
a taxa de hemorragia intracraniana foi significativamente
maior (1,12% vs. 0,64%), o que impediu
a sua comercialização. Em contraponto à vantagem da
administração em bolo, todos estes mutantes do tPA
necessitam de heparinização plena por 24-48 horas.
Entre os novos agentes, apenas o tenecteplase foi recentemente lançado no Brasil, com preço semelhante
ao do tPA.
Os benefícios da terapia trombolítica ou da
angioplastia primária independem da idade, do sexo e
da maioria das características basais. Entretanto os
pacientes que mais se beneficiam com as estratégias de
reperfusão são aqueles tratados mais precocemente, os
idosos, aqueles com IAM de parede anterior, ou com
outros aspectos de alto risco.
Terapia combinada de
Embora o ácido acetilsalicílico promova inequívoca
redução da mortalidade por IAM, sua ação
antiplaquetária é relativamente fraca, pois decorre da
inibição apenas da via do tromboxane A2. Os antagonistas
da glicoproteína IIb/IIIa são potentes agentes
antiplaquetários que bloqueiam a via final comum da
agregação e adesão plaquetária. Em face das crescentes
evidências de que grande parte do mecanismo
fisiopatológico responsável pelo freqüente insucesso da
trombólise está relacionada à ativação plaquetária, diversos
estudos com a combinação de dose reduzida de
trombolíticos e GP IIb/IIIa têm sido desenvolvidos.
trombolítico + antagonistas
da GPIIb/IIIa
O estudo Timi-14, um dos mais importantes estudos-
piloto nesta linha de investigação, avaliou o uso
concomitante do abciximab com vários esquemas de
tPA ou SK. Ao final de 90 minutos, as taxas de fluxo
Timi-3 foram de 32% para abciximab isolado, um valor
comparável à SK isolada em outros estudos; 34% a
46% para SK + abciximab; e 61% a 76% para tPA
(meia dose) + abciximab, em comparação com 57%
para tPA (dose plena) isolado. Estes resultados promissores
não foram confirmados em grandes ensaios.
No estudo Gusto-5, com mais de 16.500 pacientes, o
esquema rPA (meia dose) + abciximab, quando comparado
com rPA (dose padrão), não produziu diferença
de mortalidade de 30 dias (5,6% vs. 5,9%). Houve
benefício moderado com a terapia da combinação em
relação à incidência de reinfarto não-fatal (2,3% vs.
3,5%), isquemia recorrente (11,3% vs. 12,8%), necessidade
de revascularização e outras complicações
não-fatais do infarto. Não houve aumento das taxas
de hemorragia intracraniana, mas a combinação aumentou
o risco de outros sangramentos.
O estudo Assent-3 incluiu 6.095 pacientes com
IAM e comparou três esquemas: tenecteplase (dose
plena) + enoxiparina, tenecteplase (meia dose) +
heparina não-fracionada + abciximab, e tenecteplase
(dose plena) + heparina não-fracionada. Os objetivos
primários (mortalidade em 30 dias, reinfarto ou
isquemia refratária) foram significativamente menores
nos 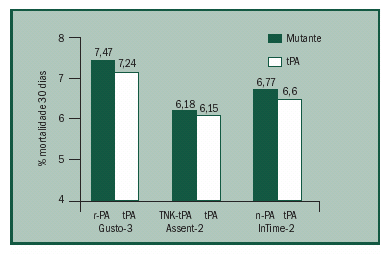 grupos abciximab e enoxiparina em relação ao
grupo heparina não-fracionada, e equivalentes entre
si: 11,1% (abciximab), 11,4% (enoxiparina) e 15,4%
(heparina não-fracionada). O mesmo comportamento
foi observado em relação à segurança. Estratégia
semelhante foi avaliada no estudo Entire-Timi-23,
onde 483 pacientes foram tratados de acordo com
quatro esquemas: dose plena de TNK-tPA (com
heparina não-fracionada ou enoxiparina) ou meia dose
de TNK-tPA + abciximab (com heparina nãofracionada
ou enoxiparina). Os resultados sugerem que
a enoxiparina está associada a taxas de fluxo Timi-3 semelhantes
à heparina não-fracionada na fase inicial da
trombólise, com vantagens em relação aos eventos isquêmicos
ao final de 30 dias, e semelhante risco
hemorrágico. Apesar da pequena casuística, vale ressaltar
que a associação TNK-tPA (dose plena) + enoxiparina
apresentou a menor taxa de eventos isquêmicos (4,4%),
quando comparado com terapia combinada TNK-tPA
(meia dose) + abciximab, tanto com enoxiparina (5,5%)
como com heparina não-fracionada (6,5%).
grupos abciximab e enoxiparina em relação ao
grupo heparina não-fracionada, e equivalentes entre
si: 11,1% (abciximab), 11,4% (enoxiparina) e 15,4%
(heparina não-fracionada). O mesmo comportamento
foi observado em relação à segurança. Estratégia
semelhante foi avaliada no estudo Entire-Timi-23,
onde 483 pacientes foram tratados de acordo com
quatro esquemas: dose plena de TNK-tPA (com
heparina não-fracionada ou enoxiparina) ou meia dose
de TNK-tPA + abciximab (com heparina nãofracionada
ou enoxiparina). Os resultados sugerem que
a enoxiparina está associada a taxas de fluxo Timi-3 semelhantes
à heparina não-fracionada na fase inicial da
trombólise, com vantagens em relação aos eventos isquêmicos
ao final de 30 dias, e semelhante risco
hemorrágico. Apesar da pequena casuística, vale ressaltar
que a associação TNK-tPA (dose plena) + enoxiparina
apresentou a menor taxa de eventos isquêmicos (4,4%),
quando comparado com terapia combinada TNK-tPA
(meia dose) + abciximab, tanto com enoxiparina (5,5%)
como com heparina não-fracionada (6,5%).
Estes resultados reafirmam a segurança da enoxiparina
com o tPA e seus mutantes, o que, pela facilidade e custo-
efetividade, parece constituir estratégia atrativa e mais
adequada do que a associação de abciximab a trombolítico.
Em breve tempo, novos ensaios já em curso devem definir
a melhor combinação de trombolíticos e antitrombóticos
no tratamento do IAM.
Em metanálise de seis ensaios e mais de 6.400 pacientes,
a trombólise pré-hospitalar reduziu em quase
uma hora o tempo para início do tratamento (162min
± 16min vs. 104min ± 7min), contribuindo para diminuir
a mortalidade em 17%. No recém-publicado
estudo ER-Timi-19, o tempo médio entre a chegada
ao atendimento de emergência e o início da trombólise
com rPA foi reduzido de 63min para 31min, quando
comparadas as abordagens pré-hospitalar e hospitalar.
A mortalidade hospitalar foi de 4,7%, com 1% de hemorragia
intracraniana.
A trombólise pré-hospitalar foi comparada com
a angioplastia primária no estudo Captim, sendo observada
diferença não-significativa nos objetivos
compostos de mortalidade global, reinfarto ou acidente
vascular encefálico em favor da angioplastia
(8,2% vs. 6,2%).
É importante lembrar que a trombólise pode ser
efetiva mesmo em pacientes com mais de 12 horas de
evolução, principalmente na presença de sintomas e
alterações eletrocardiográficas compatíveis com
isquemia em curso. Os benefícios da trombólise tardia
estão provavelmente relacionados à patência
vascular (hipótese da artéria aberta), com melhor cicatrização
ventricular, menor expansão da área de infarto
e maior estabilidade elétrica.
Mais recentemente, o estudo dinamarquês
Danami-2 demonstrou que a estratégia de transferência
dos pacientes para realizar angioplastia primária
reduziu em 40% o risco relativo de óbito, reinfarto ou
acidente vascular encefálico, quando comparada com
a trombólise hospitalar, desde que não houvesse retardo
maior que três horas.
Trombólise em pacientes de
Entre os pacientes de maior atenção pela alta mortalidade
por IAM destacam-se os subgrupos com tempo
de evolução > 4 horas, localização anterior, idade >
65 anos, sexo feminino, supradesnível de ST em mais
de seis derivações, bloqueio de ramo adquirido, infarto
prévio, pressão arterial < 100mmHg, freqüência cardíaca
> 100bpm, diabetes melito, insuficiência cardíaca e choque
cardiogênico.
alto risco
Trombólise no idoso (classe I se < 75
Com o progressivo envelhecimento da população,
é cada vez maior o número de pacientes idosos que
apresentam IAM. Independente do tratamento, os
idosos têm alta mortalidade, e muitos apresentam comorbidades
que podem contra-indicar a terapia
trombolítica.
Sexo feminino
Choque cardiogênico
Seleção do agente trombolítico
anos; classe IIa se 75 anos)
Estudos pioneiros como Gissi-1 e Isis-2 demonstraram
que a mortalidade em pacientes tratados com
SK foi três vezes maior nos pacientes > 75 anos, como
seria esperado. A mortalidade foi reduzida em termos
absolutos em 3,9% (25% vs. 29% com placebo), benefício
50% maior que aquele constatado em pacientes
mais jovens (10,7% vs. 8,3%).
No levantamento feito pelo grupo Fibrinolytic Therapy
Trialists´ (FTT), a terapia trombolítica reduziu de forma
significativa a mortalidade para pacientes entre 65 e 74
anos (13,5% vs. 16,1% com placebo, p < 0,00001), mas
não em pacientes 75 anos (24,3% vs. 25,3%). Em nova
análise deste estudo direcionada para idosos > 75 anos e
considerados elegíveis para trombólise de acordo com os
critérios atuais (elevação de ST ou bloqueio de ramo com
até 12 horas de evolução), a mortalidade ao final de 35
dias foi significativamente reduzida (29,4% vs. 26%,
p = 0,03). Esta redução absoluta de 34 vidas salvas em
mil pacientes tratados é semelhante à observada na faixa
de 65 a 74 anos (40 vidas salvas em mil) e maior do que
em pacientes < 55 anos (16 vidas por mil).
Em contraste com os benefícios da trombólise no
idoso observados nos ensaios clínicos, outros relatos não
detectaram benefícios. Estudo retrospectivo de um banco
de dados americano (Medicare) com 7.864 pacientes
com idades entre 65 e 86 anos identificou que aqueles
com > 75 anos submetidos à trombólise apresentaram
mortalidade 38% maior ao final de 35 dias, em especial
no sexo feminino. Outro estudo com 37.983 pacientes
65 anos e com IAM não identificou benefício ao final
de 30 dias, mesmo após correção para dados
demográficos, fatores clínicos e intervenções. Neste
mesmo estudo, o subgrupo tratado com angioplastia
primária apresentou mortalidade 21% menor, mas, ao
final de um ano, as duas estratégias foram benéficas,
com vantagem para o grupo tratado com intervenção
(redução de mortalidade de 29% vs. 16%).
Apesar do inquestionável benefício da trombólise
para o idoso, sua utilização é bastante limitada, tanto
na faixa entre 65 e 75 anos (19% de utilização) como
acima de 75 anos (7,4%), em contraste com o emprego
em metade dos pacientes com menos de 65 anos.
Vários são os motivos para explicar estas baixas taxas
de utilização, além da preocupação com sangramentos.
Mais freqüentemente os idosos são atendidos além das
seis horas do início dos sintomas, e os achados eletrocardiográficos
são menos diagnósticos de IAM. Os sintomas
de infarto são menos típicos e a presença de comorbidades
pode contra-indicar o uso de trombolíticos.
De maneira equivocada, o infarto do idoso muitas vezes
é considerado de menor risco.
Em um estudo retrospectivo, a taxa de hemorragia
intracraniana pós-trombólise em pacientes 65
anos foi de 1,43%, observando-se relação direta com
os seguintes preditores independentes: idade 75 anos,
sexo feminino, raça negra, acidente vascular
encefálico prévio, pressão arterial 160mmHg, uso
de tPA, anticoagulação excessiva (INR 4) e baixo
peso ( 65kg para mulheres e 80kg para homens).
As recomendações atuais são de que a idade
não deva impedir a trombólise, classificando-a
como IIa em pacientes > 75 anos.
No estudo Gusto-I, as mulheres apresentaram
maior mortalidade em 30 dias (11,3% vs. 5,5%), diferença
que cai para 15% após ajustes para características
basais, especialmente idade.
No estudo Gusto-I, nos pacientes que não apresentavam
choque cardiogênico, o tPA determinou redução
de mortalidade e da taxa de desenvolvimento
de choque, quando comparado com SK. Entretanto,
nos pacientes com choque houve tendência não-significativa
para menor mortalidade com SK. No estudo
Gusto-III, os pacientes com choque cardiogênico melhoraram
com tPA, mas não se beneficiaram com rPA.
Não há dados randomizados demonstrando a eficácia
e a segurança do balão de contrapulsação intraaórtica
e trombólise no choque cardiogênico pós-IAM,
mas há sugestões de eficácia segundo observações dos
estudos Shock e Gusto-1. Assim, a presença de choque
cardiogênico deve ser vista como fator limitante
da eficácia, e não como contra-indicação ao uso de
trombolíticos. Neste contexto, o implante da
contrapulsação intra-aórtica deve ser feito cuidadosamente
por profissionais experientes, sem que se retarde
o início da trombólise.
Tanto para pacientes jovens como para idosos que
se apresentam com evidência de isquemia miocárdica
aguda, a questão central é se o paciente é candidato à
trombólise. Se indicada a trombólise, a seleção do agente
poderá ser feita com dados oriundos do estudo
Gusto-1, onde 12% e 4% dos pacientes tinham mais
de 75 e 80 anos, respectivamente. Na faixa etária acima
de 75 anos, o tPA em regime acelerado de administração
determinou redução não-significativa da
mortalidade (19% vs. 21% com SK), mas com expressiva
maior incidência de hemorragia intracraniana
(2,1% vs. 1,2%). Em pacientes > 85 anos houve tendência
a menor mortalidade com SK (29,4% vs. 30%
com tPA), mas os dados são muito limitados.
Marcadores de reperfusão
A qualidade do fluxo coronariano obtida com a
trombólise depende de vários fatores, como a hemodinâmica
(pressão de perfusão coronariana, freqüência
cardíaca, drenagem venosa), anatomia local (tamanho
e tônus vasculares, localização, gravidade, extensão
e geometria da lesão), quantidade de trombo residual
(tempo para reperfusão, retrombose, ativação plaquetária
e atividade da trombina) e fatores celulares (função
endotelial, expressão de moléculas de adesão,
interações imunológicas e integridade microvascular). A patência vascular (fluxo Timi 2 ou 3) pode ser obtida
em 60% a 75% dos pacientes, mas apenas a
reperfusão ideal ou completa (Timi 3) se traduz em
real redução da mortalidade (3,7% vs. 7% com fluxo
Timi 2). Os pacientes com fluxo Timi 3 também se
caracterizam por menores picos de marcadores de
necrose miocárdica, menos anormalidades de contração
segmentar e menor depressão da fração de ejeção. Os benefícios da reperfusão plena se estendem a longo
prazo, observando-se menor mortalidade ao final de
dois anos (7,9% vs. 15,7%, fluxo Timi 0, 1 ou 2).
pós-trombólise
Apesar de importante, a detecção clínica da
reperfusão não pode ser feita de maneira totalmente
confiável na maioria dos pacientes. Por diversos motivos,
o desaparecimento da dor torácica não pode ser
utilizado como indicativo da eficácia terapêutica. O
comportamento dos marcadores de necrose miocárdica
pode ser útil na identificação da reperfusão. A
reperfusão obtida nas seis horas iniciais de evolução
do IAM determina alterações da cinética de liberação
dos marcadores, reduzindo o tempo entre o início do
infarto e o pico de CK, assim como um aumento na
magnitude do pico de CK em relação ao tamanho do
infarto. Isto é mais evidente quando a reperfusão ocorre
nas primeiras quatro horas. Mais recentemente, foi
descrito que relações entre os níveis séricos aos 60 minutos
após o início da trombólise e basais de mioglobina
4, de CK-MB 3,3 e de troponina I 2 forneceram
probabilidades de Timi II ou III de 90%, 88%
e 87%, respectivamente.
As arritmias de reperfusão podem oferecer pequena
contribuição na análise da eficácia da trombólise,
pois as mais freqüentemente observadas, como a
taquicardia ventricular e a fibrilação ventricular, também
o são em pacientes não-submetidos ou malsucedidos com a terapia trombolítica. Uma arritmia que
tem sido correlacionada com a restauração da patência
vascular é o ritmo idioventricular acelerado, freqüentemente
denominado taquicardia ventricular lenta.
Com freqüência entre 60bpm e 125bpm, a maioria
dos episódios é de curta duração, terminando abruptamente,
alentecer gradualmente antes do término ou
ser suprimida pela aceleração do ritmo de base. Habitualmente
não há necessidade de nenhum tratamento
antiarrítmico, pois não há evidências de que possa induzir
taquicardia ou fibrilação ventricular. Se houver
repercussão clínica (rara) com distúrbio hemodinâmico
ou angina, recomenda-se aceleração da freqüência
de base com atropina ou marca-passo atrial.
A regressão ou resolução da elevação do segmento ST após
a terapia trombolítica é considerada um marcador de
reperfusão e de valor prognóstico, permitindo identificar
potenciais candidatos à angioplastia de resgate. Ao final de
três horas, a resolução completa do ST ( 70% de resolução),
parcial (30% a 70%) ou ausente (< 30%),
correlacionou-se com taxas de mortalidade ao final de cinco
semanas de 2,5%, 4,3% e 17,5% (p < 0,0001), respectivamente.
A regressão de ST em três horas foi o preditor
mais potente de mortalidade e, quando possível, a análise
mais precoce (em 60-90 minutos) pode orientar e antecipar
a decisão acerca da intervenção hemodinâmica. A rápida
resolução de ST também se correlaciona com o achado
de recanalização precoce com adequada perfusão
miocárdica e melhor contratilidade segmentar. Por outro
lado, a permanência de infradesnível de ST em derivações
não-relacionadas ao infarto ou oscilações recorrentes (elevação
ou depressão) de ST após a resolução inicial do ST
identificam pacientes de alto risco para eventos adversos. A presença de ondas Q patológicas ou inversão de onda T
no ECG de admissão está associada com pior resposta à
trombólise, perfusão miocárdica inadequada e alterações
de contratilidade segmentar, enquanto que o não-desenvolvimento
de ondas Q pressupõe menor extensão e intensidade
de disfunção ventricular e melhor perspectiva de
recuperação funcional.
Referências Bibliográficas
1. II DIRETRIZES DA SBC PARA O TRATAMENTO DO IAM.
Arq Bras Cardiol, v. 74, suplemento II, p. 1, 2000.
2. DiMARCO, J. Results from late-breaking clinical trials sessions
at ACC 2001. J Am Coll Cardiol, v. 38, p. 595, 2001.
3. ROSS, A. M. et al. Randomized comparison of enoxaparin, a
low-molecular-weight heparin, with unfractioned heparin
adjunctive to recombinant tissue plasminogen activator
thrombolysis and aspirin: second trial of heparin and aspirin
reperfusion therapy (Hart II). Circulation, v. 104, p. 648, 2001.
4. LLEVADOT, J.; GIUGLIANO, R. P.; ANTMAN, E. M. Bolus
fibrinolytic therapy in acute myocardial infarction. JAMA, v. 286,
p. 442, 2001.
5. THE ASSESSMENT OF THE SAFETY AND EFFICACY OF
A NEW THROMBOLYTIC REGIMEN (ASSENT)-3
INVESTIGATORS. Efficacy and safety of tenecteplase in
combination with enoxaparin, abciximab, or unfractionated
heparin: the Assent-3 randomised trial in acute myocardial
infarction. Lancet, v. 358, p. 605, 2001.
6. ANTMAN, E. M. et al. Enoxiparin as adjunctive antithrombin
therapy for ST-elevation myocardial infarction: results of the Entire-
Thrombolysis in Myocardial Infarction (Timi) trial. Circulation, v.
105, p. 1642, 2002.
7. MORRISON, L. J.; VERBEEK, P. R.; McDONALD, A. C.
Mortality and prehospital thrombolysis for acute myocardial
infarction: a metaanalysis. JAMA, v. 283, p. 2686, 2000.
8. MORROW, D. A. et al. Evaluation of the time saved by
prehospital initiation of reteplase for ST-elevation myocardial
infarction: results of the Early Retavase-Thrombolysis In Myocardial
Infarction (ER-Timi)19 trial. J Am Coll Cardiol, v. 40, p. 71, 2002.
9. WILLIAMS, E. S. Results from late-breaking clinical trial sessions
at the American College of Cardiology 51st annual scientific session.
J Am Coll Cardiol, v. 40, p. 1, 2002.
10. WONG, C-K.; WHITE, H. D. Medical treatment for acute
coronary syndromes. Curr Opin Cardiol, v. 15, p. 441, 2000.
11. THIEMANN, D. R. et al. Lack of benefit for intravenous
thrombolysis in patients with myocardial infarction who are older
than 75 years. Circulation, v. 101, p. 2239, 2000.
12. BERGER, A. K. et al. Thrombolytic therapy in older patients.
J Am Coll Cardiol, v. 36, p. 366, 2000.
13. GURWITZ, J. H. et al. Recent age-related trends in the use of
thrombolytic therapy in patients who have had acute myocardial
infarction. Ann Intern Med, v. 124, p. 283, 1996.
14. BRASS, L. M. et al. Intracranial hemorrhage associated with
thrombolytic therapy for elederly patients with acute myocardial
infarction: results from the Cooperative Cardiovascular Project.
Stroke, v. 31, p. 1802, 2000.
15. PAUL, S. D. et al. Do gender-based differences in presentation
and management influence predictors of hospitalization costs and
length of stay after an acute myocardial infarction. Am J Cardiol, v.
76, p. 1122, 1995.
16. WHITE, H. D. et al. For the Gusto-1 Investigators. Age and
outcome with contemporary thrombolytic therapy: results from the
Gusto-1 trial. Circulation, v. 94, p. 1826, 1996.
17. SANBORN, T. A. et al. Impact of thrombolysis, intra-aortic
balloon pump counterpulsation, and their combination in
cardiogenic shock complicating acute myocardial infarction: a report
from the shock trial registry. Should we emergently revacularize
occluded coronaries for cardiogenic shock? J Am Coll Cardiol, v.
36, n. 3, suppl. A, p. 1123, 2000.
18. ANDERSON, R. D. et al. Use of intra-aortic balloon counterpulsation
in patients presenting with cardiogenic shock: observations from the Gusto-
1 study. J Am Coll Cardiol, v. 30, p. 708, 1997.
19. GIBSON, C. M. et al. Determinants of coronary blood flow
after thrombolytic administration. Timi Study Group.
Thrombolysis in Myocardial Infarction. J Am Coll Cardiol, v. 34,
p. 1403, 1999.
20. ANDERSON, J. L.; KARAGOUNIS, L. A.; CALIFF, R. M.
Meta-analysis of five reported studies on the relation of early coronary
patency grades with mortality and outcomes after acute myocardial
infarction. Am J Cardiol, v. 78, p. 1, 1996.
21. TANASIJEVIC, M. J. et al. Myoglobin, creatine-kinase-MB
and cardiac troponin-I 60 minute ratios predict infarct-related
artery patency after thrombolysis for acute myocardial infarction:
results from the Thrombolysis in Myocardial Infarction Study
(Timi) 10B. J Am Coll Cardiol, v. 34, p. 739, 1999.
22. SCHRODER, R. et al. For the Injetct Trial Group. Extent of
early ST segment elevation resolution. A strong predictor of outcome
in patients with acute myocardial infarction and a sensitive measure
to compare thrombolytic regimens. A substudy of the International
Joint Efficacy Comparison of Thrombolytics (Inject) Trial. J Am Coll
Cardiol, v. 26, p. 1657, 1996.
23. DE LEMOS, J. A.; BRAUNWALD, E. ST segment
resolution as a tool for assessing the efficacy of a reperfusion
therapy. J Am Coll Cardiol, v. 38, p. 1283, 2001.