| De acordo com as diretrizes nacionais (Diretrizes Brasileiras sobre Aterosclerose) e internacionais (NCEP/ATP III), o principal objetivo para a diminuição do risco cardiovascular é a redução do nível sérico do LDL-c. Devemos, evidentemente, avaliar e estratificar individualmente o risco de cada paciente e, só então, definir qual a meta adequada e qual a intensidade da abordagem terapêutica. |
Autores Andréia Assis Loures-Vale - Mestre em Biologia Molecular pela Escola Paulista de Medicina/Unifesp; coordenadora do Departamento de Aterosclerose e do Centro de Pesquisa do Hospital Socor, de Belo Horizonte. Tânia Leme da Rocha Martinez - Professora Livre-Docente em Medicina pela Unifesp; diretora da Unidade de Dislipidemia do Incor. |
O primeiro passo para se buscar a redução do LDL-c
seria a instituição da chamada mudança de estilo de vida.
Além da grande dificuldade em se conseguirem modificações
realmente significativas, temos ainda grande número
de pacientes em que somente esta intervenção não
será suficiente para atingir as metas de LDL-c propostas.
Portanto, apesar de este ser o modo mais econômico
de tratamento, o uso de drogas hipolipemiantes
se fará necessário em grande parte da população
dislipidêmica.
Importante salientar que os fármacos serão usados
em associação ao tratamento não-farmacológico,
e não em sua substituição, e que a administração deste
tipo de medicação será precedida por uma avaliação
minuciosa de suas indicações (diagnóstico correto da
dislipidemia), sendo necessários controles sucessivos
para monitorar a resposta e a tolerabilidade.
Vários medicamentos são amplamente utilizados para
diminuir as concentrações plasmáticas de lipoproteínas.
Seu mecanismo de ação inclui (Quadro): alterações da
síntese lipoprotéica, do metabolismo intra vascular das
lipoproteínas e da sua depuração.
vascular das
lipoproteínas e da sua depuração.
Abordaremos neste fascículo os medicamentos
mais indicados para a redução do LDL-c: inibidores
da HMG-CoA redutase (ou estatinas) e seqüestrantes
de ácidos biliares (ou resinas).
Inibidores da HMG-CoA
redutase (estatinas)
As estatinas pertencem à classe de medicamentos
redutores de LDL-c mais eficazes e toleráveis, sendo,
portanto, as mais utilizadas.
As estatinas em uso atualmente são: lovastatina,
sinvastatina, pravastatina, fluvastatina, atorvastatina e
há algumas estatinas mais recentes (rosuvastatina,
itavastatina) ainda não-disponíveis para uso.
Todas atuam diminuindo o nível sérico do LDL-c
(maiores detalhes a seguir), possuem inúmeros outros
efeitos ditos pleiotrópicos, mas, apesar de pertencerem
à mesma classe, apresentam características diferentes
entre si; ainda não temos evidências concretas
de que estas diferenças traduzam resultados também
diferentes na redução de eventos clínicos. Evidentemente,
o percentual de redução do LDL-c dependerá
da droga e da dose que for utilizada.
A lovastatina, a sinvastatina e a pravastatina são
metabólitos fúngicos ou derivados destes, e a fluvastatina
e atorvastatina são totalmente sintéticas. A
lovastatina e a sinvastatina são administradas como
lactonas inativas; necessitam ser hidrolisadas (o que
ocorre dentro dos hepatócitos) para ter atividade
farmacológica, podendo, então, serem consideradas
pró-medicações. As outras estatinas são administradas
na forma ativa.
Mecanismo de ação/metabolismo
Os inibidores da HMG-CoA redutase atuam através
da inibição da 3-hidroxi-3-metilglutaril 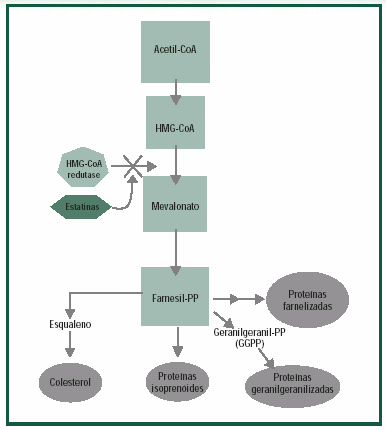 coenzima
A (Figura 1), enzima limitante da síntese do colesterol.
A inibição é decorrente do fato de as estatinas conterem,
na sua molécula, um componente de estrutura
análoga à da HMG-CoA, que possui afinidade com
a enzima milhares de vezes superior à do substrato
natural, sendo capaz de bloqueá-la competitivamente
e de forma parcial, reversível, potente e dependente
da dose.
coenzima
A (Figura 1), enzima limitante da síntese do colesterol.
A inibição é decorrente do fato de as estatinas conterem,
na sua molécula, um componente de estrutura
análoga à da HMG-CoA, que possui afinidade com
a enzima milhares de vezes superior à do substrato
natural, sendo capaz de bloqueá-la competitivamente
e de forma parcial, reversível, potente e dependente
da dose.
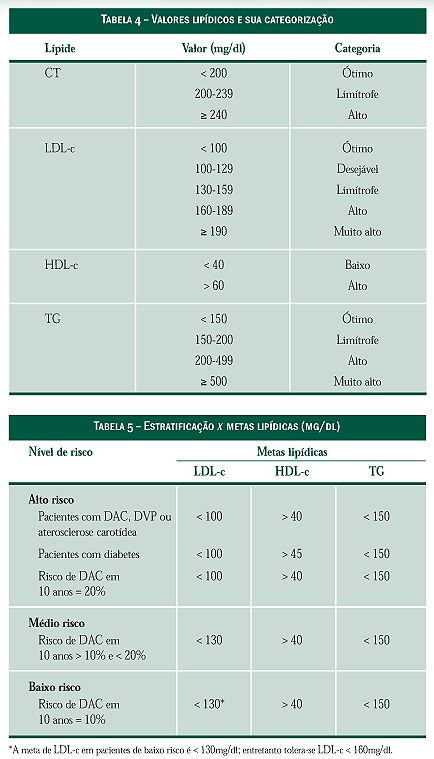
Um dos resultados essenciais da inibição do
colesterol dentro dos hepatócitos (Figura 2) é a diminuição
das reservas intracelulares de colesterol, o que
desencadeia medidas homeostáticas: estímulo de síntese
de mais receptores e aumento de atividade do receptor
da LDL na membrana celular, fazendo com que
esta lipoproteína seja retirada rapidamente da circulação,
trazendo seu conteúdo de colesterol para dentro
do hepatócito.
Além deste efeito, as estatinas também podem reduzir
a produção e aumentar a depuração hepática da VLDL,
mecanismo que explica a redução de triglicérides que
podemos obter com o uso desta classe de drogas.
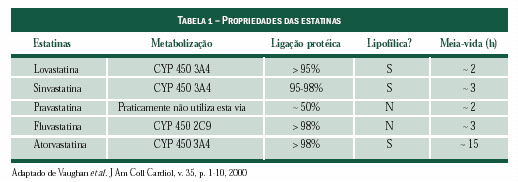
A absorção intestinal (Tabela 1) destes agentes varia
de 31% (lovastatina) a mais de 95% (atorvastatina).
Todas as estatinas se dirigem para o fígado por extração
hepática na primeira passagem (o maior percentual
é da sinvastatina: > 79%).
Estes agentes se ligam às proteínas em grande
quantidade (> 95%), exceto pela pravastatina, que
apresenta ligação protéica abaixo de 50%. Especula-
se que o elevado grau de ligação protéica poderia
minimizar o efeito destes agentes em tecidos extra-
hepáticos, diminuindo o potencial de efeitos colaterais.
A fluvastatina e a pravastatina são hidrofílicas e,
portanto, não atravessam a barreira liquórica.
A principal via de eliminação das estatinas é o fígado;
a excreção renal ocorre apenas com a pravastatina
(mesmo assim, a depuração hepática é substancial). A
insuficiência renal não provoca aumento dos níveis
séricos de pravastatina, bem como não há necessidade
de modificação das doses da fluvastatina neste
caso; maior cuidado deve ser tomado com o uso da
lovastatina em pacientes urêmicos.
 Eficácia: efeitos lipídicos (Tabela 2)
Eficácia: efeitos lipídicos (Tabela 2)
As estatinas diferem na quantidade de redução de
LDL-c que pode ser obtida com uma dose máxima. A
dose máxima aprovada de atorvastatina (80mg/dia) proporciona
uma média de 58% de redução do LDL em
pacientes hipercolesterolêmicos. Esta redução é maior que
a observada com as doses máximas das outras estatinas e
parece estar relacionada à sua maior meia-vida plasmática.
Esta distinção entre as várias estatinas torna-se importante
apenas quando há necessidade de redução máxima
de LDL, já que a maioria dos pacientes necessita de reduções
muito inferiores a 60%.
Devem ser administradas, quando em dose única,
preferencialmente à noite.
Eficácia: objetivos clínicos e aterosclerose
Na última década têm sido publicados inúmeros ensaios
clínicos que confirmam que o tratamento das
dislipidemias com fármacos hipolipemiantes é benéfico tanto
na prevenção primária quanto na secundária. Tem sido demonstrado
um decréscimo significativo da morbimortalidade
por acidentes coronarianos, da mortalidade total e da
morbimortalidade por acidentes vasculares cerebrais.
Também tem sido demonstrado que as estatinas, além
de seus efeitos sobre as concentrações plasmáticas de
lípides, influem sobre uma ampla série de fenômenos -
chamados de efeitos pleiotrópicos (como já mencionamos
anteriormente): normalizam a função endotelial,
melhoram a função vasomotora e a perfusão miocárdica,
inibem a proliferação das células musculares lisas, protegem
as LDL das modificações oxidativas, reduzem as
concentrações de PAI-1, normalizam a agregação plaquetária
e das hemácias, modulando a resposta imunológica
e antioxidante, além de diminuir a resposta inflamatória.
Através de muitas destas ações, poderia ser justificada
a rapidez pela qual as estatinas modificam as alterações
vasomotoras existentes na aterosclerose coronariana, proporcionando
um benefício clínico significativo e precoce,
que dificilmente seria devido somente à redução do
LDL-c. Nos pacientes submetidos a transplante cardíaco,
a utilização das estatinas reduz a porcentagem de
rejeição e melhora significativamente a sobrevida durante
o primeiro ano.
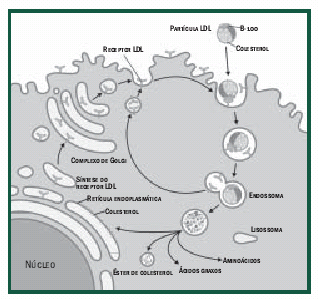
Ensaios clínicos
Existem sete grandes estudos clínicos desenvolvidos
com estatinas (Tabela 3) que demonstraram,
sem sombra de dúvida, que estas drogas são eficazes
na redução da mortalidade por DAC (doença
aterosclerótica coronariana) e na prevenção de eventos
e/ou de complicações.
São estudos bem divulgados no nosso meio (excetuando-
se talvez o HPS, publicado em julho deste ano).
Vale a pena fazermos uma análise sobre o que representa
o conjunto de informações que eles nos trazem.
Como já ressaltamos anteriormente, não há dúvidas
quanto ao benefício advindo da redução do colesterol;
entretanto estamos agora na fase de nos perguntarmos
o que deve ser mais interessante do ponto de vista de
redução de eventos: a teoria de quanto mais baixo
melhor (LDL-c) ou a análise de que reduções percentuais
se correlacionam melhor?
As reduções percentuais no LDL-c variaram de 25%
(Afcaps/TexCaps e Lipid) até 35% (4S), enquanto que
a redução média de DAC variou de 24% nos estudos
Care e Lipid até 34% no 4S; fica claro, portanto, que
este tipo de correlação foi mais eficaz do que se avaliarmos
por valores basais de CT (colesterol total) ou de LDL-c.
Assim como nos estudos clínicos, a redução de eventos
vista nos estudos angiográficos também nos permite
fazer a mesma análise de que a diminuição percentual
(%) no LDL-c seria um melhor critério da eficácia
terapêutica do que seu valor absoluto (mg/dl).
Entretanto, por que nossas diretrizes, as americanas
e as européias continuam enfatizando um determinado
valor de corte de LDL-c como meta no
tratamento?
Quando nos detemos um pouco mais nas análises
de subconjunto dos grandes estudos clínicos, temos o
combustível para reabastecer essa controvérsia atual, validando
as atuais diretrizes que colocam o nível de
LDL-c de100-130mg/dl como sendo o ideal:
a) no estudo clínico 4S, apesar de a redução no risco
relativo ter sido independente do nível basal de LDL-c,
foi demonstrada uma redução contínua no risco de
DAC até um nível de LDL-c de cerca de 80mg/dl;
b) as taxas de evento reduzem, no estudo Care, à medida
que reduzimos o nível do LDL-c (174mg/dl até
125mg/dl) (Tabelas 4 e 5);
c) finalmente, em dados de estudos epidemiológicos amplamente
conhecidos como o MRFIT (Multiple Risk Factor
Intervention Trial), Framingham e Procam (Prospective
Cardiovascular Munster), vemos que a relação entre os níveis
séricos de CT e/ou LDL-c e de DAC é contínua e graduada
de maneira curvilínea onde os quintis mais baixos de
LDL-c (média de 88mg/dl em mulheres e 95mg/dl em
homens) se correlacionam com menor incidência de DAC.
Para trazer mais luz a esta questão, devemos aguardar
a publicação dos novos estudos que testam a hipótese
de que quanto mais reduzirmos o LDL-c mais
diminuiremos as taxas de DAC.
Efeitos adversos
Em geral, as estatinas são bem toleradas, sendo seus
efeitos secundários mais freqüentes cefaléia, flatulência,
dispepsia, dores musculares, prurido e exantema cutâneo.
O exemplo de efeito adverso importante seria a
hepatoxicidade manifestada por elevação das transaminases;
é dose-dependente, geralmente assintomática e lentamente
reversível após interrupção do medicamento. A freqüência
deste efeito colateral é de aproximadamente 1% e
parece estar relacionada à inibição da HMG-CoA redutase.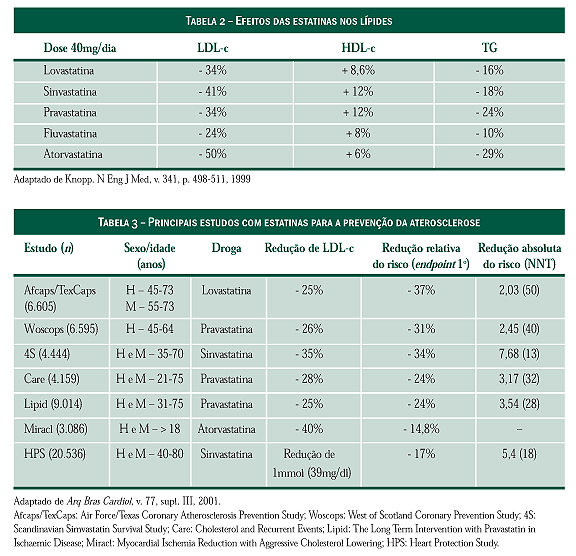
Não há necessidade de interrupção do tratamento com
pequenas elevações das transaminases, somente quando
temos valores acima de três vezes o valor normal e podemos
reiniciar o medicamento, em doses mais baixas, após
restauração dos valores normais. Deve-se realizar monitorização
laboratorial após seis e 12 semanas do início do
tratamento e a cada seis meses, daí em diante.
Outro fator adverso importante, porém raro, é a
miopatia (0,1% - resultados publicados dos diversos estudos
clínicos com estatinas): provoca fraqueza extrema,
mialgias e elevação da CPK até dez vezes acima de seus
limites normais. A associação com ciclosporina,
eritromicina, antifúngicos, antibióticos macrolídeos,
fibratos (genfibrozil) e ácido nicotínico pode aumentar as
probabilidades de miopatia que, excepcionalmente, pode
ser complicada por rabdomiólise e necrose tubular aguda.
Recomendações terapêuticas
De acordo com as III Diretrizes sobre Aterosclerose
da Sociedade Brasileira de Cardiologia, o primeiro
passo que devemos dar ao abordar um paciente
hipercolesterolêmico será o de estratificar o seu
risco para a doença aterosclerótica - não entraremos
em detalhes por não ser este o objetivo do nosso
artigo.
Após a estratificação, iremos prescrever o tratamento
farmacológico de acordo com a Tabela 6.
Seqüestrantes de ácidos
Estes fármacos são utilizados desde a década de
1960, após a descoberta de que a exclusão ileal, projetada
para reduzir a ingestão de colesterol dietético, também
reduzia os ácidos biliares.
biliares (resinas)
A colestiramina e o colestipol são os principais representantes
desta classe e, até meados da década de
1980, eram os principais fármacos redutores de
colesterol. Com o advento das estatinas e sua incontestável
melhor tolerabilidade e maior potencial de
redução, estes medicamentos foram sendo substituídos
e, hoje, são utilizados em algumas situações especiais
e como terapia adjuvante quando a redução de
LDL-c não é satisfatória apenas com o uso das estatinas.
Como são medicamentos de ação no nível intestinal
e não-sistêmicos, seus efeitos colaterais são mínimos
e, por isso, representam a droga ideal no tratamento
de crianças e grávidas hipercolesterolêmicas.
Tanto a colestiramina (Questran Light®) quanto o
colestipol (não-disponível no Brasil) estão disponíveis em
pó e devem ser misturados a líquidos antes da ingestão.
Existe ainda um outro representante dessa classe,
aprovado nos Estados Unidos no ano de 2000, ainda
não-disponível no nosso país, que é o coleveselan. Representa
uma nova formulação de resinas, com melhor
tolerabilidade e com bons resultados quando usado
em associação com estatinas.

Mecanismo de ação
Essas drogas são resinas trocadoras de ânions, e sua
administração inicia uma seqüência complexa de eventos
que resultam no aumento da atividade do receptor de
LDL, resultando em maior depuração na LDL plasmática.
São polímeros, insolúveis em água, resistentes às
enzimas digestivas e capazes de unir-se aos ácidos
biliares na luz intestinal. Esta ligação com os ácidos
biliares e sua posterior eliminação nas fezes, interrompendo
sua circulação entero-hepática (Figura 3),
reduzem a absorção de ácido biliar no íleo. O fígado,
depletado de bile, já que a excreção fecal pode aumentar
de três a 15 vezes, sintetiza uma maior quantidade
de reservas hepáticas de colesterol. Como o
colesterol é convertido em ácidos biliares em taxas
elevadas, sua concentração diminui dentro dos
hepatócitos.
É importante ressaltar que a redução conseguida
nos níveis de colesterol sérico com estes fármacos é
dependente de seus efeitos na via exógena da hipercolesterolemia.
Efeitos sobre as lipoproteínas e uso em
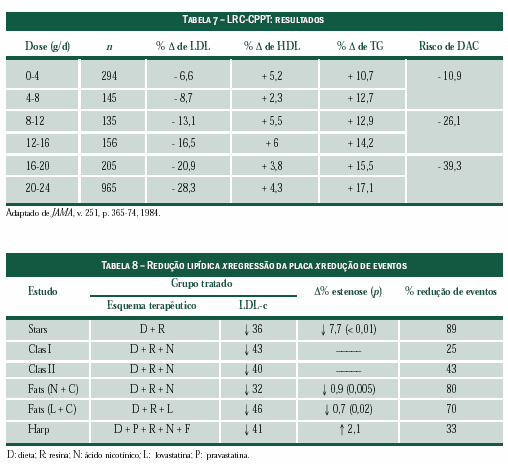
No Estudo de Prevenção Coronária Primária da
Clínica de Pesquisas de Lípides (LRC-CPPT), 3.806
homens foram distribuídos aleatoriamente para tratamento
com colestiramina ou placebo. Os participantes
do grupo ativo tomaram 12g (três pacotes) duas
vezes ao dia, mas
ensaios clínicos
 a aderência à medicação variou.
a aderência à medicação variou.
Houve relação linear entre o consumo da colestiramina
e a redução do LDL-c, e a diminuição do risco
coronariano correspondeu às alterações da dose da
medicação e da taxa de redução do LDL-c (Tabela 7).
A colestiramina exerce seu efeito predominante
sobre o LDL-c, podendo apresentar pequenos aumentos
no HDL-c (de 2% a 3%), como também pode
ocasionar aumento de triglicérides secundário a aumentos
da fração VLDL-c. Portanto deverá ser contra-
indicada àqueles pacientes que apresentem
dislipidemias mistas ou hipertrigliceridemia.
Além do ensaio clínico descrito anteriormente, as
resinas também foram utilizadas em importantes estudos
que se baseavam em dados angiográficos, como, por
exemplo, no Clas (Ensaio de Redução dos Níveis de
Colesterol na Aterosclerose), Fats (Ensaio de Tratamento
da Aterosclerose Familial), Harp (Projeto Harvard de
Reversibilidade da Aterosclerose) e Stars (Ensaio de Regressão
da Aterosclerose de St. Thomas) (Tabela 8).
Efeitos adversos
Como não são absorvidas pelo intestino, as resinas
não possuem toxicidade sistêmica e são consideradas
os hipolipemiantes mais seguros. No entanto
provocam freqüentes intolerâncias digestivas (constipação,
flatulência ou náuseas) já presentes em doses
baixas do medicamento e que têm uma relação de
piora com o aumento da dose utilizada.
Outro ponto que prejudica a adesão do paciente ao
tratamento com as resinas diz respeito a sua
palatabilidade: relato de boca cheia de areia. Estas drogas
deverão ser administradas misturadas a um líquido
(geralmente suco de laranja) e iniciadas sempre em pequenas
doses (4g = um pacote de colestiramina) com
aumentos sucessivos até a dose máxima recomendada
de 24g/dia. Os pacientes devem ter os seus níveis de
vitaminas solúveis em gordura checados periodicamente
e a necessidade de uma reposição deve ser sempre
avaliada, principalmente nas crianças.
Podem apresentar interação medicamentosa com
outros agentes igualmente iônicos se administrados
simultaneamente; com warfarin, l-tiroxina, hidroclorotiazida
e estatinas (de modo geral) essa interferência
já está bem documentada e a administração da
resina deverá ser feita uma hora antes ou quatro horas
depois da tomada dos medicamentos citados.
Considerações finais: custo/
A avaliação da relação de custo/efetividade do tratamento
para reduzir o colesterol depende da população
em questão, do risco absoluto para DAC e da
redução relativa alcançada. Depende ainda do custo
da intervenção e, no caso de drogas, da dose utilizada
e do preço unitário.
efetividade do tratamento da
hipercolesterolemia
Pode ser expressa por diminuições na morbimortalidade
e em intervenções, reduções de risco, melhora
em índices de qualidade de vida e como aumento
no custo por ano de vida salva (sigla YLS).
Na literatura internacional há um consenso em
se considerar a abordagem da prevenção secundária,
com o uso de estatina, mandatória e altamente compensatória
do ponto de vista de custo/efetividade. Já
com relação à prevenção primária, ficamos diante de
todas as condicionais já descritas; o risco absoluto do
paciente deve ser estabelecido, e em cima do resultado
é que poderemos verificar se, do ponto de vista
econômico (é bom ressaltar isso) vale a pena tratar.
Há algumas publicações que colocam que se o risco
exceder 1,5% ao ano, já teremos uma relação
satisfatória para o uso de estatinas; de acordo com
nossas diretrizes, os pacientes classificados como de
médio risco estariam nesta categoria.
Persiste a dúvida quanto àqueles pacientes jovens
e portadores de alterações lipídicas (desde que não
estejamos diante de uma hipercolesterolemia familiar,
que por si só já leva o paciente à categoria de alto risco)
sem outro fator de risco importante: trataremos
ou não? Nestes casos, irão prevalecer a nossa avaliação
e o bom senso.