| Em 1955 Jerome Conn(1) descreveu o caso de uma paciente de 34 anos que apresentava quadro clínico de hipertensão severa e hipopotassemia, revertido inteiramente após a remoção cirúrgica de um adenoma da supra-renal direita que secretava aldosterona. A nova síndrome clínica – síndrome de Conn ou hiperaldosteronismo primário (HAP) – caracterizava-se por aumento da excreção urinária de potássio, taxas elevadas de secreção de aldosterona e diminuição da atividade plasmática de renina, além de hipopotassemia e hipertensão arterial. Descrições subseqüentes de casos de HAP mostraram que não só adenomas solitários, mas também a hiperplasia bilateral das supra-renais, causavam as mesmas alterações clínicas e laboratoriais. Outros subtipos de HAP, como formas familiares, hiperplasia adrenal primária e carcinoma adrenocortical, foram publicados entre a década de 1970 e o início dos anos 1990(2-4). Em que pese o melhor conhecimento da síndrome de Conn e suas causas, até 1990 a prevalência de HAP na população de hipertensos ficava entre 0,05% e 2%(5, 6). Era então considerada causa incomum de hipertensão arterial. |
Nos últimos anos, vários grupos independentes de investigadores comprovaram que a doença não só era muito mais freqüente, como ocorria em hipertensos normopotassêmicos( 7, 9). Contribuem para este cenário os critérios de rastreamento mais eficientes e o desenvolvimento de métodos ancorados nos mais recentes avanços da bioquímica, da genética e da biologia molecular. Novas técnicas de imagem, como a tomografia computadorizada, também tiveram um papel importante.
Atualmente admite-se que uma estratégia de diagnóstico corretamente aplicada à população de hipertensos poderá identificar pelo menos um entre dez hipertensos atendidos em clínicas de hipertensão como portadores de HAP(10).
A mesma proporção pode se repetir em hipertensos que procuram serviços de atenção médica primária(11). Embora não haja unanimidade, entre os grupos que estudam HAP, quanto à maior prevalência da síndrome, não se pode negar que o tema tem grande importância, principalmente se levarmos em conta que um número razoável de pacientes não está se beneficiando de tratamentos mais específicos e até mesmo curativo de sua hipertensão arterial.
Causas de hiperaldosteronismo
Adenomas secretores de aldosterona e hiperplasia adrenal
bilateral ou hiperaldosteronismo idiopático são as causas mais
freqüentes de HAP(7). Entre os adenomas secretores existe
uma variante, o adenoma secretor responsivo à angiotensina,
em que a secreção de aldosterona não é autônoma, respondendo
ao ortostatismo e à angiotensina(12). Outra variante
é a hiperplasia adrenal unilateral ou hiperplasia adrenal
primária, que tem características bioquímicas idênticas às
de adenomas secretores, apresenta níveis urinários elevados,
de 18-OH-cortisol e 18-oxocortisol, podendo ser controlada
pela adrenalectomia unilateral(13). A ocorrência familiar
de HAP é rara, menos de 3% dos casos de HAP, existindo
um subtipo herdado por transmissão autossômica dominante,
o FH-I, que se associa a um gene híbrido. O FH-I
apresenta-se clinicamente com hipertensão severa e resistente
aos agentes anti-hipertensivos usuais; os pacientes são
habitualmente normopotassêmicos e o quadro clínico pode
ser revertido pela administração de dexametasona(14). O outro
tipo familiar de HAP, o FH-II, não responde à supressão
com glicocorticóide, não se relaciona à presença de mutação
genética e se manifesta por características clínicas e bioquímicas
indistinguíveis dos adenomas solitários ou da hiperplasia
adrenal bilateral(14). Os carcinomas adrenocorticais
são muito raros e acabam por ser descobertos como massas
tumorais funcionantes, geralmente volumosas, com mais
de 6cm de diâmetro.
primário
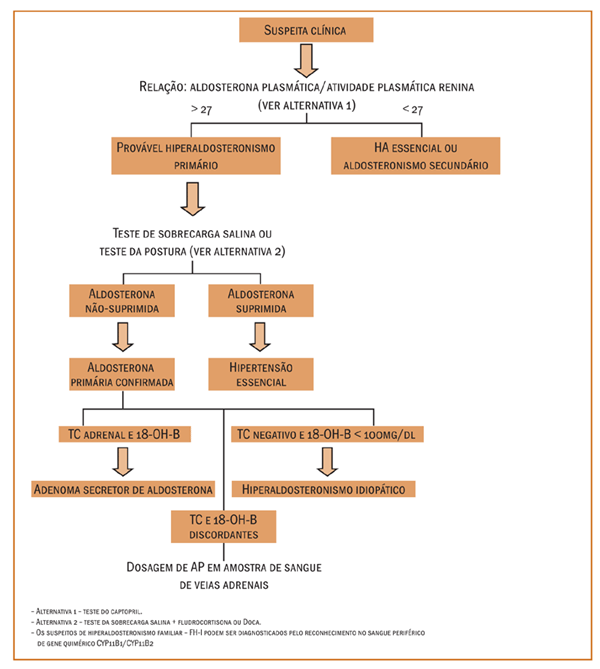
Diagnóstico de hiperaldosteronismo
primário (ver Figura 1)
Testes de screening
Embora a hipopotassemia esteja presente em muitos
pacientes com HAP, é um indicador pouco sensível e pouco
específico da doença. Por exemplo, a administração de dieta
hipossódica prolongada interfere nos mecanismos de perda
de potássio pelo rim, diminuindo sua excreção urinária, o
que atenua a hipopotassemia. Por outro lado, algumas séries
de casos têm mostrado que apenas 20% a 30% dos pacientes
com HAP são portadores de hipopotassemia (14-15).
Níveis séricos de potássio
Atividade plasmática de renina (APR)
Por conta da expansão do volume extracelular, a
APR está suprimida em quase todos os pacientes com
HAP (< 1ng/ml/h), e não aumenta apropriadamente
(> 2ng/ml/h) após 120 minutos em posição ereta, restrição
de sódio ou administração de furosemida(16). O teste
é um indicador mais sensível que a hipopotassemia ou os
níveis elevados de aldosterona no plasma ou na urina.
Contudo tem pouca especificidade, pois a APR diminui
com a idade. Além disso, pacientes que apresentam níveis
baixos de APR e aldosterona normal têm sido rotulados
como hipertensos essenciais com renina baixa(17),
embora a maioria dos mesmos não tenha sido cuidadosamente
estudada para se excluir HAP normopotassêmico.
Relação aldosterona plasmática/atividade
A relação AP/APR vem sendo considerada um dos testes
de screening mais confiáveis para o possível diagnóstico
de HAP, mostrando altas sensibilidade e especificidade(4).
Uma relação (quando a APR for expressa em ng/ml/h e a
AP, em ng/dl) maior que 25 é sugestiva, e quando igual ou
maior que 50, virtualmente diagnostica HAP. Numerosos
investigadores, de várias partes do mundo - Lim (Reino
Unido)(10), Gordon (Austrália)(7), Young (Estados Unidos)(16)
e Loh (Cingapura)(18) -, e que vêm publicando as maiores
séries de casos de HAP, mostram que a relação AP/APR
aumentou em mais de dez vezes a freqüência de detecção da
doença, não só em hipertensos hipopotassêmicos, mas também
naqueles com hipertensão resistente e normopotassêmicos
(Tabela). Para um destes autores, a relação AP/APR
teve sensibilidade de 93% quando comparada ao teste de
supressão com fludrocortisona ou à presença de HAP comprovado
cirurgicamente(10). Por outro lado, em estudos
prospectivos envolvendo pacientes com AP/APR elevada, o
tratamento com espirolactona diminuiu significativamente
a pressão arterial e o número de medicamentos necessários
para controlar a hipertensão(19).
plasmática de renina (AP/APR)
Embora os valores da relação AP/APR, a partir dos quais
o diagnóstico de HAP passa a ser sugestivo, não sejam os
mesmos nas várias séries de casos publicados, já que foram
diferentes as condições locais e as características dos grupos
estudados(20, 21), os seguintes pontos devem ser observados
para o melhor rendimento do teste: 1) drogas antihipertensivas
como inibidores de ECA, betabloqueadores e
clonidina deverão ser suspensas duas a quatro semanas antes
da obtenção das amostras de sangue; quanto à
espirolactona, este prazo aumenta para seis a oito semanas.
Quando for necessário, controlar a hipertensão com bloqueadores
1 pós-sinápticos, diuréticos tiazídicos e bloqueadores
de canal de cálcio; 2) os pacientes precisam estar
repletados de potássio, já que a hipopotassemia reduz os
níveis de aldosterona; 3) as amostras de sangue deverão ser
obtidas no meio da manhã e duas horas após, em posição
ereta devido à variação circadiana e aos efeitos da postura
sobre os níveis de AP e APR; 4) atentar se a AP está expressa
em unidades internacionais (pmol/l) e se o laboratório utiliza
a renina plasmática ativa ao invés da APR em ng/ml/h.
Neste caso, a relação AP/renina plasmática ativa estará acima
de 140 no HAP e abaixo de 100 em hipertensos essenciais.
Entre 100 e 140, recomenda-se a repetição do teste(5).
Teste do captopril
Nos pacientes com produção autônoma de aldosterona,
a administração de captopril tem pouco ou nenhum
efeito sobre as concentrações de aldosterona e níveis de APR,
podendo, assim, diferenciar casos de HAP dos pacientes
hipertensos essenciais. Em hipertensos essenciais, com sistema
renina-angiotensina normal, o captopril diminui a angiotensina
II e a aldosterona, embora níveis elevados de renina
estejam presentes devido à inibição da angiotensina. O protocolo
é muito simples e consiste na mensuração dos níveis
plasmáticos de aldosterona antes e 2 horas após a administração
por via oral de 25mg de captopril. Recomenda-se
que os pacientes permaneçam em jejum por 12h, que o
sangue seja coletado na posição sentada e que anti-hipertensivos
como espirolactona, bloqueadores betadrenérgicos e
clonidina sejam suspensos(5). O teste tem correlação altamente
significativa com os valores obtidos após sobrecarga
salina(22), é bem tolerado, a pressão arterial permanece estável
durante o estudo e parece não ser afetado pelas variações
individuais da ingesta de sódio. A redução em mais de 20%
dos níveis de aldosterona pós-captopril - usualmente menos
que 410pmol/l (< 15ng/dl) - é considerada resposta
normal. Este teste tem sensibilidade excelente, entre 90% e
100%, mas sua especificidade é de 50% a 80%(4).
Testes confirmatórios
A relação AP/APR não estabelece o diagnóstico de HAP.
A síndrome precisa ser confirmada pela demonstração de
que a secreção de aldosterona é autônoma. Entre os protocolos
freqüentemente utilizados, e sobre os quais se tem maior
experiência, podemos citar os que se seguem.
Teste da sobrecarga salina
O teste de sobrecarga salina consiste em se administrar
por via oral, durante três dias, aproximadamente 10g de
cloreto de sódio ou, como alternativa, dois litros de soro
fisiológico, durante quatro horas, visando a suprimir a produção
de aldosterona que ocorre com a expansão do volume
extravascular. Se a excreção urinária de 24h de aldosterona,
após sobrecarga oral de sódio, for superior a 28mmol/
dia a 39mmol/dia (10mg/dia a 14mg/dia), na presença de
excreção urinária de sódio maior de 250mmol/dia, o diagnóstico
de HAP está praticamente confirmado, com excelentes
sensibilidade e especificidade (96% e 93%, respectivamente)(
8). Se utilizarmos os níveis fisiológicos de AP após
expansão do volume intravascular com soro, valores acima
de 280pmol/d (> 10ng/dl) também são fortemente consistentes
com o diagnóstico de HAP(23).
Alguns autores combinam a sobrecarga salina por via
oral com a administração de acetato fludrocortisona, 0,1mg
a cada seis horas(4). Níveis de AP superiores a 240pmol/l
(8,5ng/dl) ou de aldosterona urinária maiores que 12mg/
24h confirmam que a secreção de aldosterona não foi suprimida,
o que praticamente confirma o diagnóstico da HAP.
Pode-se usar a desoxicorticosterona (Doca) em substituição
à fludrocortisona, administrando-se 10mg do mineralocorticóide
de 12h/12h, por via intramuscular, durante três dias
consecutivos, e medindo-se a excreção urinária de aldosterona
24 horas antes do início e no terceiro dia após o uso de
Doca. Em hipertensos essenciais pode haver diminuição de
pelo menos 50% na aldosteronúria, enquanto nos pacientes
com HAP a queda é inferior a 10%. Atentar para o fato
de que pacientes com hiperplasia adrenal bilateral comportam-
se, em relação à supressão com Doca ou fludrocortisona,
como hipertensos essenciais. Assim, a não-supressão da
secreção de aldosterona, além de caracterizar o HAP, permite
o diagnóstico diferencial entre adenoma secretor de aldosterona
(ASA) e hiperplasia adrenal bilateral (HAI). É
útil também a relação da AP (em ng/dl) e as concentrações
de cortisol no plasma (em mg/dl), que costuma ser inferior
a 3 nos pacientes com HAI. Em contrapartida, em portadores
de ASA, o valor é geralmente superior a 3, mostrando
a autonomia do adenoma.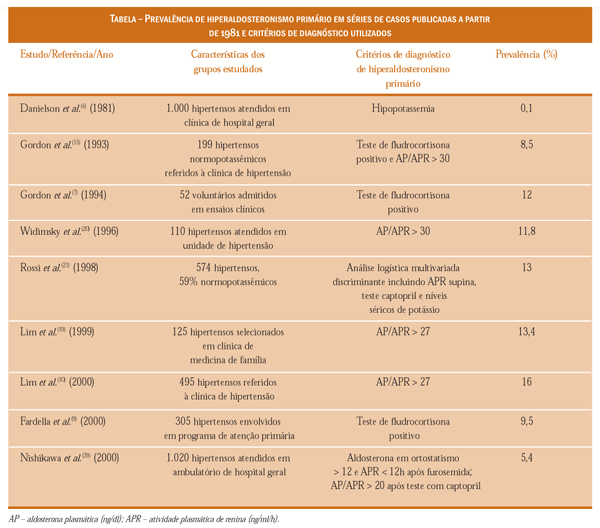
Deterioração da função diastólica ventricular esquerda
e aumento do intervalo QT têm sido descritos com o protocolo
de sobrecarga salina associado à fludrocortisona, principalmente
se o paciente tiver hipertensão arterial ou insuficiência
cardíaca subclínica(24).
Teste da postura
Outro protocolo que permite distinguir os ASA da
HAI é a resposta da AP e do cortisol à mudança
postural(25). Em indivíduos normais e hipertensos essenciais,
as concentrações plasmáticas de aldosterona se elevam
pelo menos 50% duas a quatro horas após
deambulação ou adoção da posição ereta. A acurácia do
teste aumenta quando se medem simultaneamente os
níveis de cortisol e AP. Em pacientes com ASA, ambas as
variáveis não se elevam com a mudança postural, podendo
mostrar até redução quando em ortostatismo. Em
contrapartida, os portadores de HAI, quando assumem
a postura ereta, respondem à mesma com aumento de
dois a três níveis da AP e da APR em relação aos níveis
basais(26). O valor preditivo do teste da postura em distinguir
os ASA e casos de HAI é de 90%, embora sua
especificidade seja menor devido aos subtipos de ASA e
de HAI. O declínio postural da AP também acontece
nos subtipos (FH-I), que são controlados pela administração
de dexametasona.
A dosagem na urina de 24h dos compostos cortisólicos
híbridos 18-oxigenados-18-oxocortisol e 18-OH-cortisol
pode diagnosticar a variante FH-I e diferenciar os ASA dos
casos de HAI. Ambos são importantes marcadores de FHI,
podendo apresentar níveis dez vezes superiores aos valores
de referência. Estes níveis estão discretamente aumentados
no ASA e normais em pacientes com HAI(27).
Por outro lado, os níveis sangüíneos de 18-
hidroxicorticosterona (18-(OH)-B), que é produto intermediário
da via de síntese da aldosterona, estão usualmente
acima de 2.800nmol/ml (100mg/dl) em indivíduos com
ASA, diferenciando-os, assim, daqueles com HAI que mostram
níveis significativamente menores(28) (Figura).
Diagnóstico radiológico do
hiperaldosteronismo primário
A tomografia computadorizada (TC) é o método radiológico
mais utilizado para a avaliação anatômica das adrenais
em pacientes suspeitos de HAP. Os ASA, quando têm entre
1cm e 3cm de diâmetro, podem ser detectados pela TC,
principalmente se o exame for feito utilizando-se cortes de
3mm.
Tendo-se em vista os resultados de várias séries de casos
de ASA publicados recentemente(8, 9), chega-se à conclusão
de que a TC não pode ser considerada padrão-ouro de diagnóstico.
Por exemplo, a TC detectou apenas 47% dos ASA
comprovados cirurgicamente em uma das maiores séries de
casos de HAP, não diagnosticando um quarto dos tumores
medindo menos de 1cm de diâmetro(14). Isto é significativo
quando se sabe que um entre cinco adenomas de suprarenal
tem menos de 1cm de diâmetro. Nesta mesma série, a
TC mostrou-se claramente equivocada, diagnosticando
massas nas adrenais contralaterais, mas não nas ipsilaterais.
Em outra série menor, estudada por McAlister e
Lewanczuk(29), dos 18 pacientes com HAP, 13 tiveram o
diagnóstico de ASA comprovado cirurgicamente e os demais
mostraram HAI não-funcionante. É importante ressaltar
que 2% a 10% dos tumores diagnosticados pela TC
não são produtores de aldosterona (14). Mas em pacientes
com HAI as adrenais poderão parecer normais ou bilateralmente
aumentadas, com ou sem micronódulos(30).
Os dados mencionados acima, outras evidências da prática
clínica e estudos de séries de casos têm apontado que a
coleta de sangue por cateterismo seletivo de uma das veias
adrenais é o único método confiável para diferenciar o aumento
unilateral de produção de aldosterona, passível portanto
de correção cirúrgica, de casos de HAI. Deve-se, também,
considerar que os adenomas responsivos à angiotensina
II são bioquimicamente indistintos dos casos de HAI. Isto
reforça, ainda mais, a importância do exame como método
indispensável para este diagnóstico. O cortisol plasmático
deve ser estimado simultaneamente, mas em alíquota de
sangue coletada separadamente, para que se comprove a
origem da amostra obtida. O gradiente cortisol/veia adrenal
e cortisol/veia cava inferior deve ser igual ou superior a 3
para que os resultados possam ser considerados confiáveis.
Em mãos experientes, e quando o cateterismo da veia adrenal
direita for feito com sucesso, o procedimento faz o diagnóstico
em mais de 95% dos casos. Contudo a incidência de
insucesso pode chegar a 25%(4).
Mutações genéticas e
Em 1992, Lifton et al.(31) descreveram um teste utilizando
metodologia Southern blot para reconhecer no sangue
periférico o DNA de um gene híbrido que firmaria o
diagnóstico de HAP familiar, subtipo FH-I. Três anos depois,
Jonsson et al.(32) relataram um método mais rápido
utilizando PCR, com os mesmos objetivos. Estes foram uns
dos passos mais importantes para a caracterização de formas
primárias e familiares de aldosteronismo, passíveis de serem
controláveis pelo uso de dexametasona administrada em
doses orais de 0,5mg a 2mg por dia(33). Estes casos, até então,
eram diagnosticados pela demonstração de supressão
da secreção de aldosterona pelo teste da dexametasona sujeito
a falsos positivos e falsos negativos(9, 34). A partir daí
inúmeros casos de HAP foram reconhecidos em famílias de
várias partes do mundo(9, 35, 36), estabelecendo-se que o subtipo
da doença é causado pela herança de um gene mutante ou
quimérico formado pela combinação do CYP11B1, gene
que codifica a enzima 11ß-hidroxilase (promove a 11ßhidroxilação
da DOC, para formar corticosterona na zona
glomerular e zona fasciculata, e do 11-deoxicortisol, para
formar cortisol na zona fasciculata) e o gene CYP11B2, que
codifica a aldosterona sintase (participa da conversão na zona
glomerulosa da cortiscosterona em aldosterona) e que, nos
casos de HF-I, sintetiza 18-OH-cortisol e 18-oxocortisol.
O gene mutante resulta na expressão ectópica de aldosterona
sintase, que passa a ser controlada pelo ACTH, e não
pela angiotensina II (31, 37, 38) Embora raros, menos de 3%
dos pacientes com HAP, os portadores de FH-I podem ser
reconhecidos numa fase bastante precoce, pré-clínica, de
HAP quando nem hipertensão arterial nem hipocalemia
estão presentes. Como já foi mencionado, o outro subtipo
de HAP familiar, FH-II, não se associa a mutação de gene
híbrido, tem características clínicas, bioquímicas e
morfológicas indistinguíveis de casos de ASA ou HAI e parecem
ser mais freqüentes que o subtipo FH-I(34).
hiperaldosteronismo primário